Rodzice i chorzy często niepokoją się niektórymi sformułowaniami na wynikach badań mikrobiologicznych. W oparciu o własne doświadczenia z rozwiewaniem takich obaw przedstawiamy poniżej zbiorcze wyjaśnienia podstawowych wątpliwości.
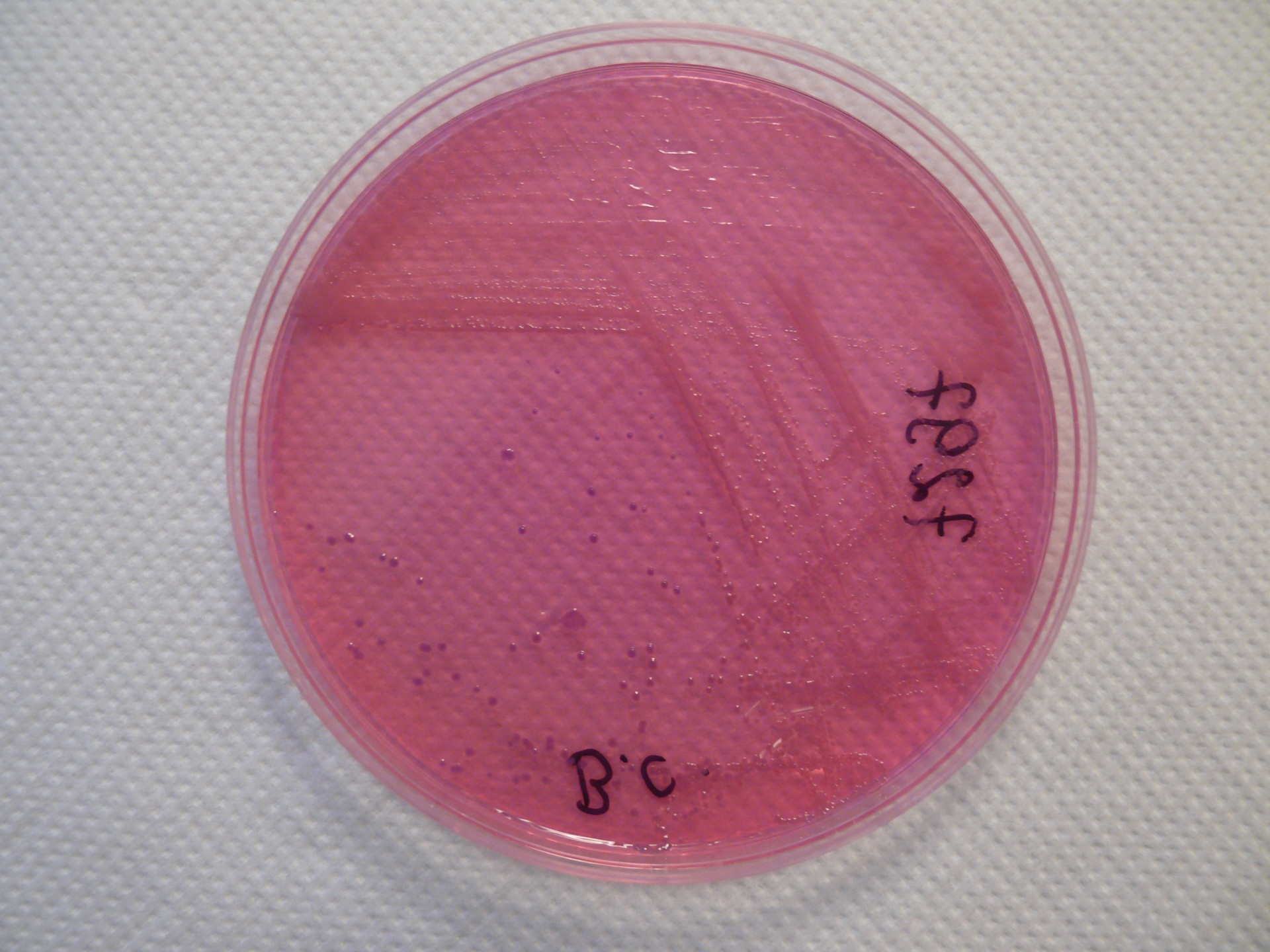
Na podłożu wybiórczym Burkholderia cepacia medium – brak wzrostu
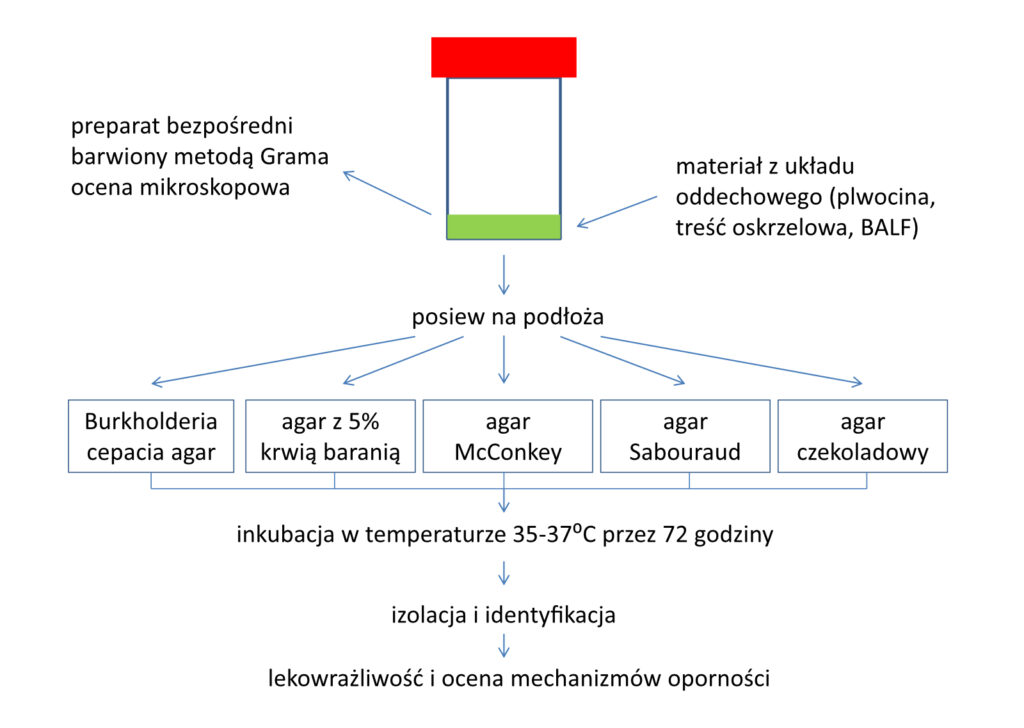
W diagnostyce mikrobiologicznej materiałów z układu oddechowego od chorych na mukowiscydozę musi znaleźć się metoda ułatwiająca wykrywanie zakażeń wywoływanych przez kompleks bakterii o wspólnej nazwie Burkholderia cepacia (zob. więcej: „Mukowiscydoza” nr 27, str. 3). Ze względu na jej wolny wzrost na typowych pożywkach stosowanych w mikrobiologii często nie udaje się stwierdzić jej obecności, ponieważ inne bakterie, jak Pseudomonas aeruginosa (pałeczka ropy błękitnej) czy Staphylococcus aureus (gronkowiec złocisty), zarastają całą hodowlę.
Dla uniknięcia takiej sytuacji, czyli wyniku fałszywie ujemnego, stosuje się tzw. podłoża selektywne (wybiórcze). W ich skład wchodzi zestaw różnych antybiotyków, które uniemożliwiają lub znacznie hamują wzrost innych bakterii, nie szkodząc jednocześnie gatunkowi, który chcemy wyhodować. Zatem w tytułowym określeniu „Burkholderia cepacia medium” to nazwa jednego z podłóż wybiórczych stosowanych do wykrywania wzrostu Burkholderia cepacia. Dalsza część opisu „brak wzrostu” jednoznacznie potwierdza, że w materiale pozyskanym od chorego nie stwierdzono obecności tej bakterii. Czyli uzyskujemy wynik ujemny (dobry) – prawidłowy, potwierdzający, że chory nie jest zakażony przez Burkholderia cepacia.
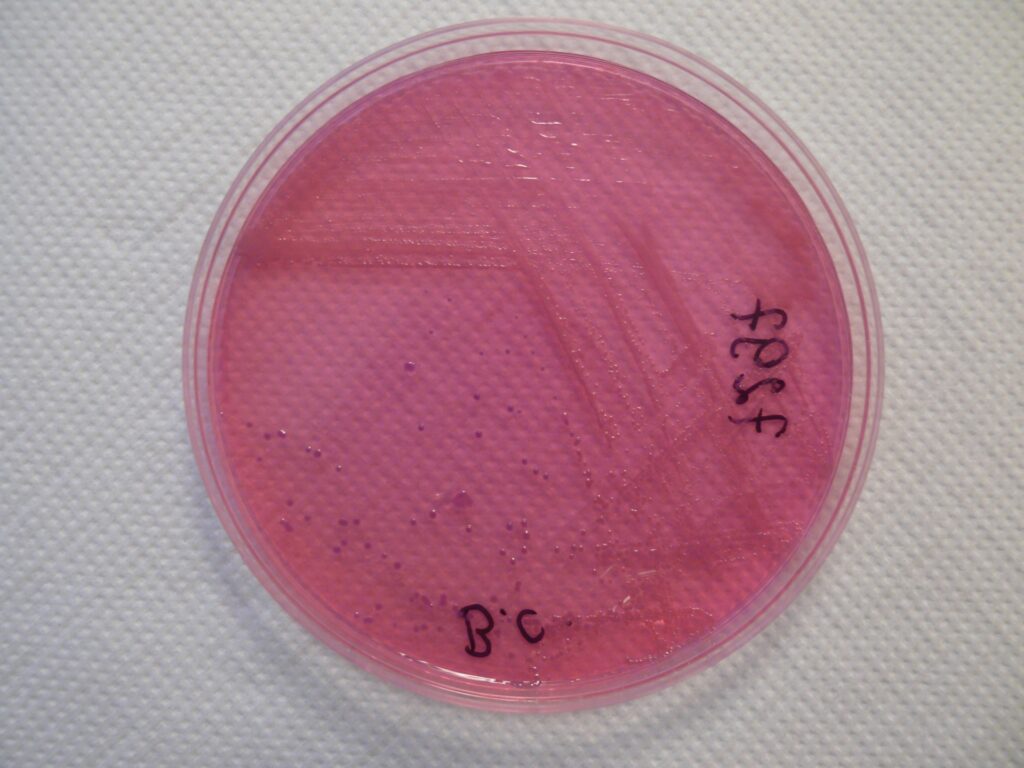
Jeżeli natomiast wynik będzie brzmiał np. „wyhodowano liczne kolonie Burkholderia cepacia” wówczas jest to zła informacja, potwierdzająca zakażenie chorego tą bakterią.
Patogen alarmowy
To określenie można spotkać przy niektórych szczepach bakterii, np. „Achromobacter xylosoxidans, liczne kolonie, patogen alarmowy”.
Obowiązek umieszczania informacji o tzw. patogenach alarmowych wynika z Rozporządzenia Ministra Zdrowia z dnia 11 marca 2005 r. w sprawie rejestrów zakażeń zakładowych oraz raportów o występowaniu tych zakażeń (Dz. U. z dnia 3 kwietnia 2005 r.). Załącznik nr 1 do tego rozporządzenia zawiera listę 16 różnych drobnoustrojów określonych jako „drobnoustroje alarmowe”. Ideą tego zestawienia było m.in. przekazywanie informacji między szpitalami o drobnoustrojach wymagających szczególnej uwagi od personelu szpitalnego, w tym np. decyzji o izolowaniu chorego.
Spośród bakterii w sposób szczególny interesujących chorych na mukowiscydozę na liście umieszczono:
- gronkowiec złocisty (Staphylococcus aureus) oporny na metycylinę (MRSA) lub glikopeptydy (VRSA),
- pałeczki Gram-ujemne (Enterobacteriaceae) wytwarzające beta-laktamazy o rozszerzonym spektrum substratowym (ESBL) lub oporne na karbapenemy,
- pałeczka ropy błękitnej (Pseudomonas aeruginosa) oporna na karbapenemy lub inne dwie grupy leków.
Jak widać, wśród wymienionych bakterii o umieszczeniu na liście decyduje ich oporność na wybrane grupy antybiotyków.
MRSA (ang. Methicillin Resistant Staphylococcus Aureus) to szczepy gronkowca złocistego oporne na grupę tzw. antybiotyków beta-laktamowych (penicyliny, cefalosporyny, karbapenemy). Z kolei VRSA (ang. Vancomycin Resistant Staphylococcus Aureus) to szczepy gronkowca oporne na glikopeptydy – wankomycynę i teikoplaninę.
Enterobacteriaceae to rodzina bakterii, w skład której wchodzą między innymi takie gatunki jak: Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens. Ich wspólną cechą jest duża łatwość wytwarzania mechanizmu obrony przed antybiotykami, nazywanego ESBL (ang. Extended-Spectrum Beta-Lactamases). W języku polskim określamy go jako wytwarzanie przez bakterie beta-laktamaz o rozszerzonym spektrum substratowym. Beta-laktamazy to enzymy bakteryjne, które niszczą wiązania ß-laktamowe w cząsteczkach antybiotyków. Dzieli się je na dwie grupy:
- Beta laktamazy klasyczne – rozkładające penicyliny i cefalosporyny I generacji, które są wrażliwe na tzw. inhibitory beta-laktamaz – np. kwas klawulanowy, który dodany do antybiotyku przywraca jego skuteczność antybakteryjną (np. Augmentin® to skojarzenie amoksycyliny z kwasem klawulanowym – na samą amoksycylinę bakterie są oporne, ale dodatek niewielkiej ilości kwasu klawulanowego przywraca ich wrażliwość),
- Beta laktamazy o rozszerzonym spektrum substratowym (ESBL) – rozkładają penicyliny, cefalosporyny II, III i IV generacji oraz monobaktamy; w leczeniu takich zakażeń z grupy antybiotyków beta-laktamowych pozostają tylko karbapenemy (np. Tienam®, Meronem®) i połączenia z inhibitorami (np. Tazocin®).
Jeżeli na wyniku badania mamy adnotację ESBL(-) to znaczy, że dany szczep nie wytworzył jeszcze tego rodzaju mechanizmu obronnego. Jeżeli zaś napisano ESBL(+), wówczas mamy do czynienia ze szczepem o znacznie większej oporności na antybiotyki.
Pseudomonas aeruginosa może nabyć oporność na Tienam® i Meronem® (karbapenemy) przy zachowaniu wrażliwości na pozostałe antybiotyki, ale taki szczep już jest kwalifikowany do grupy drobnoustrojów alarmowych. Jeżeli szczep jest wrażliwy na karbapenemy, ale oporny na aminoglikozydy (tobramycyna, amikacyna) i jednocześnie np. na cefalosporyny (ceftazydym), wówczas również będzie zaliczany do patogenów alarmowych.
Wzmiankowane wyżej rozporządzenie MZ daje prawo kierownikowi zakładu opieki zdrowotnej lub zespołowi kontroli zakażeń zakładowych do poszerzenia listy o inne drobnoustroje, w zależności od bieżącej sytuacji epidemiologicznej.
W Oddziale Terenowym IGiChP w Rabce-Zdroju, ze względu na dużą liczbę leczonych chorych na mukowiscydozę, zaliczono do nich między innymi:
- Achromobacter xylosoxidans – oporny na dwie grupy antybiotyków,
- Burkholderia cepacia – niezależnie od zakresu oporności,
- Stenotrophomonas maltophilia – niezależnie od zakresu oporności.
Mechanizmy oporności
Oprócz wyżej opisanych, zamieszczane są również informacje o lekooporności typu MBL i MLSB.
MBL to metalo-beta-laktamazy klasy B – enzymy produkowane głównie przez Pseudomonas aeruginosa niszczące penicyliny, cefalosporyny i karbapenemy oraz ich połączenia z inhibitorami. Spośród antybiotyków beta-laktamowych do leczenia pozostaje tylko grupa monobaktamów – czyli w praktyce aztreonam. Podstawowa różnica między ESBL a MBL to wrażliwość tych pierwszych na karbapenemy i połączenia z inhibitorami, ale oporność na aztreonam.
MLSB – to mechanizm oporności polegający na zmianie w budowie jednej z części komórki bakteryjnej, tzw. rybosomu, która jest bakteriom niezbędna do produkcji białek. Na rybosomy działają następujące antybiotyki: makrolidy, linkozamidy, streptograminy B (MLSB). Zmiana w budowie rybosomu bakteryjnego powoduje, że wymienione grupy leków nie mogą hamować ich działania i dzięki temu bakterie nabywają oporność na te antybiotyki (np. klindamycyna, azytromycyna, klarytromycyna).
Metody oceny wrażliwości na antybiotyki
Do oznaczania oporności bakterii na antybiotyki wykorzystuje się różne metody. Najczęstszą z nich jest tzw. metoda dyfuzyjno-krążkowa. Na pożywkę z rosnącymi na niej bakteriami kładzie się mały krążek bibuły nasyconej standardową ilością jednego antybiotyku. Obserwacja zahamowania wzrostu bakterii w okolicy krążka określa, czy bakterie są wrażliwe, czy oporne – decyduje o tym mierzona w milimetrach szerokość przestrzeni wokół krążka, w której bakterie nie urosły.
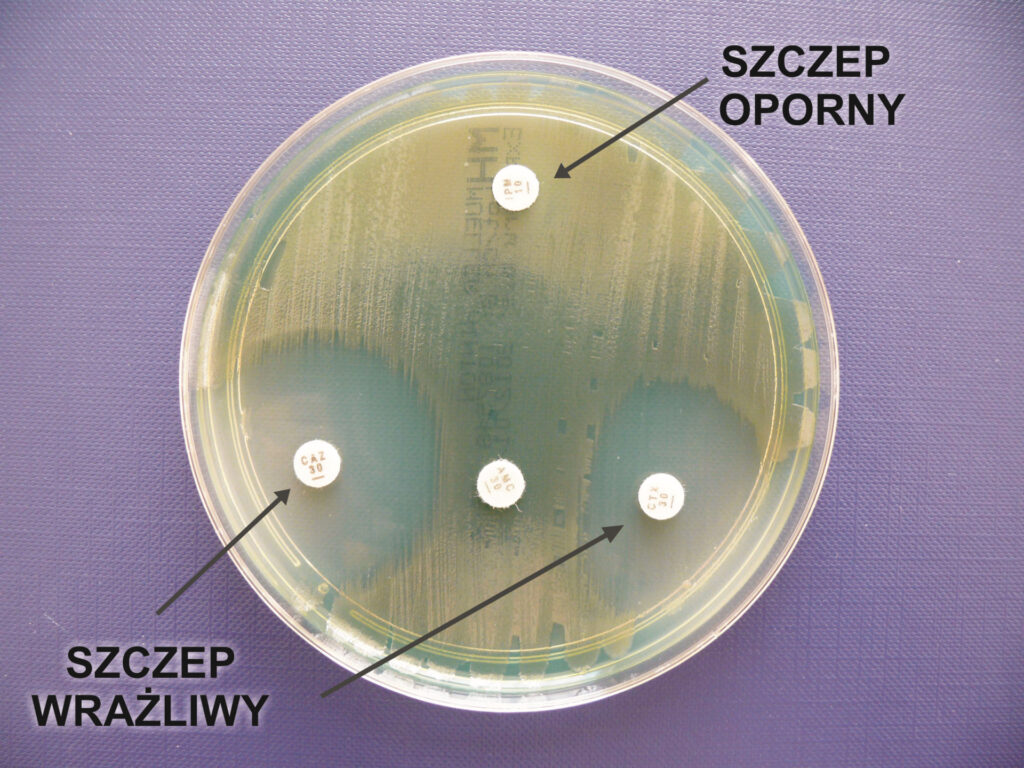
Wynik jest określany jako:
- szczep oporny (ang. resistant – R),
- szczep wrażliwy (ang. sensitive – S),
- szczep średnio wrażliwy (ang. intermediate – I).
W przypadku niektórych szczepów stosuje się metodę dokładniejszą, ale znacznie droższą, tzw. E-testy. Są to paski bibułowe, w których stężenie antybiotyku zmienia się płynnie w ich osi długiej od niskiego do wysokiego. Obserwacja strefy pozbawionej bakterii wokół E-testu umożliwia określenie tzw. MIC (ang. Minimal Inhibitory Concentration), czyli minimalnego stężenia hamującego. MIC określa najniższe stężenie antybiotyku (w mg/l) hamujące wzrost bakterii.
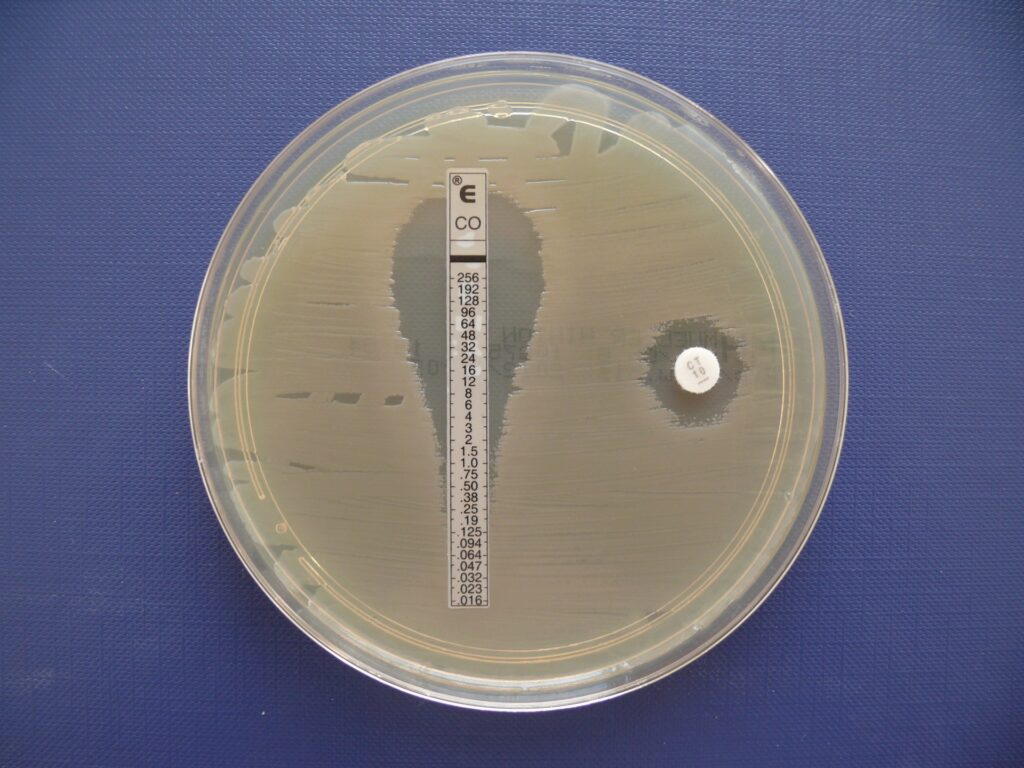
Wrażliwość bakterii na antybiotyki jest badana w laboratorium w warunkach „idealnych”. W przypadku decyzji o leczeniu zakażenia u chorego człowieka należy uwzględnić m.in. duże różnice w przechodzeniu antybiotyku do miejsca zakażenia. Stąd na wynikach spotykamy również oznaczenia wartości SIQ. Jest to iloraz stężenia we krwi osiąganego przy podawaniu danego leku przez wartość MIC tego antybiotyku dla określonego szczepu bakterii. Uznaje się, że antybiotyk jest skuteczny, jeżeli wartość SIQ przekracza 4. Przy niższych wartościach stężenie antybiotyku w miejscu zakażenia może się okazać za niskie dla zwalczenia zakażenia. W przypadku mukowiscydozy, gdzie zakażenie ma miejsce w oskrzelach i miąższu płucnym, ocena stężeń osiąganych przez antybiotyki w tych okolicach jest bardzo trudna.
Naturalna flora górnych dróg oddechowych
Powyższe określenie odnosi się do kilku lub kilkunastu gatunków bakterii obecnych w gardle, nosie, czasem w tchawicy i oskrzelach u zdecydowanej większości zdrowych ludzi. Zatem ich stwierdzenie np. w posiewie wymazu z gardła lub wymazu z nosa uznaje się za stan prawidłowy. Z tego względu w laboratorium OT IGiChP w Rabce-Zdroju nie wymienia się poszczególnych gatunków, opisując je zbiorczo. Należą do nich między innymi:
- Streptococcus viridans,
- Moraxella catarrhalis,
- Staphylococcus epidermidis,
- Streptococcus salivarius.
W skład tej flory wchodzą również drożdże, w tym Candida albicans. Najczęściej pojawiają się po leczeniu antybiotykiem jako tzw. „flora przejściowa”. Ich obecność w wymazie z gardła nie stanowi u większości chorych istotnego problemu.
W badaniach mikrobiologicznych materiałów z dolnych dróg oddechowych (oskrzela i płuca) u ludzi zdrowych zazwyczaj nie stwierdza się wzrostu żadnych bakterii. Jednak sposób pobierania materiału może mieć wpływ na wyhodowanie flory górnych dróg oddechowych również z tych jałowych okolic. Dla przykładu: wprowadzając bronchoskop przez nos i gardło do tchawicy i oskrzeli, przesuwa się nim po śluzówkach górnych dróg oddechowych pacjenta i tym samym wprowadza część jego własnych bakterii do miejsc potencjalnie jałowych. Biorąc to pod uwagę, stwierdzenie wzrostu flory górnych dróg oddechowych w posiewie treści oskrzelowej nie jest traktowane jako patologia.
Naturalna flora górnych dróg oddechowych jest jednym z elementów ludzkiej odporności na zakażenia. Bakterie wchodzące w jej skład utrudniają bakteriom patogennym zakażanie układu oddechowego. Stosując antybiotyk, działa się nie tylko na bakterie wywołujące zakażenie, ale również na własną, „dobroczynną” florę chorego człowieka. Zmniejszenie liczby bakterii ułatwia rozwój grzybów, co powoduje, że wzrost np. Candida albicans staje się znacznie bardziej intensywny.
Powyżej/poniżej 25 granulocytów obojętnochłonnych w polu widzenia
Materiał pobierany z dolnych dróg oddechowych, np. prawidłowo odkrztuszona plwocina (nie ślina!) lub treść oskrzelowa odessana przez bronchoskop, jest badany mikroskopowo pod kątem oceny jego przydatności do badania mikrobiologicznego. Stwierdzenie obecności licznych neutrofilów (granulocyty obojętnochłonne) w polu widzenia mikroskopu przy 100-krotnym powiększeniu (ponad 25 w polu widzenia) znacznie zwiększa prawdopodobieństwo wyhodowania patogennych bakterii oraz przemawia za istnieniem stanu zapalnego. Jeżeli neutrofilów jest mało (poniżej 25 w polu widzenia), wówczas istnieje mniejsza szansa na wyhodowanie bakterii.
Ocena mikroskopowa pozwala również na stwierdzenie obecności komórek nabłonka płaskiego, pochodzących z jamy ustnej. Przy dużej ich ilości pobrany materiał jest mało wiarygodny do diagnostyki mikrobiologicznej. Niejednokrotnie okazuje się, że to, co chory uznał za swoją plwocinę, jest tak naprawdę śliną – a to materiał nienadający się do diagnostyki zakażeń dolnych dróg oddechowych.
Stwierdzenie w ocenianym mikroskopowo materiale obecności nabłonków oskrzelowych oraz makrofagów jest jednoznacznym dowodem na jego pochodzenie z dolnych dróg oddechowych. Jeżeli dodatkowo nie stwierdza się obecności bakterii ani neutrofilów, wówczas taki wynik przemawia za brakiem stanu zapalnego w oskrzelach.
PLWOCINA – wykrztuszana przy kaszlu wydzielina pochodząca z tchawicy i oskrzeli
ŚLINA – płynna zawartość jamy ustnej pochodząca ze ślinianek
Bakterie w preparacie
Takie adnotacje na wyniku, jak: „w preparacie – ziarniaki o morfologii gronkowca” albo „w preparacie pałeczki Gram-ujemne”, albo „w preparacie obecne liczne ziarenkowce Gram-dodatnie o morfologii pneumokoka” przyspieszają rozpoznanie zakażającej bakterii – wynik jest dostępny po kilku godzinach od pobrania. Pozwalają również na podejrzewanie większego znaczenia patogennego jednego z kilku wyhodowanych gatunków bakterii, zwłaszcza jeżeli nie wykonuje się posiewu ilościowego.
Posiewy ilościowe
Plwocinę, treść oskrzelową lub popłuczyny oskrzelowo-pęcherzykowe można również badać pod kątem liczby bakterii danego gatunku zawartych w 1 ml pobranego materiału (gęstość). Uzyskane wyniki są wyrażane w przykładowej postaci: „Haemophilus influenzae 4,8 x 104 cfu/ml”. Skrót cfu (ang. colony forming unit) oznacza „jednostki tworzące kolonie”, co określa pojedyncze bakterie, z których rozwijają się kolonie bakteryjne stwierdzane w czasie badania. Zatem w podanym przykładzie jest mowa o tym, że w badanym materiale było 48 000 komórek Haemophilus influenzae (pałeczka grypy) w każdym mililitrze badanego materiału.
W przypadku badania plwociny chorych na mukowiscydozę niejednokrotnie uzyskuje się wyniki sięgające 109 cfu/ml, czyli miliard bakterii w 1 ml plwociny.
Laboratoria mikrobiologiczne wykonują posiewy ilościowe dość rzadko, głównie ze względów finansowych (pracochłonność). Metodą pośrednią, umożliwiającą szacunkową ocenę gęstości bakterii w badanym materiale, stanowi ocena liczności wzrostu ich kolonii w hodowli. Do tego celu służą takie określenia, jak: „kilka, kilkanaście, kilkadziesiąt, liczne, bardzo liczne kolonie”. Stwierdzenie wzrostu bardzo licznych kolonii danej bakterii przemawia za jej większym znaczeniem chorobowym niż bakterii, którą wyhodowano tylko w kilku koloniach.
Szczepy śluzowe
Niektóre bakterie nabywają w pewnych sytuacjach zdolności do produkcji otoczki śluzowej. Ich typowym przykładem jest Pseudomonas aeruginosa (P.a.). Zwykle chorzy na mukowiscydozę zakażają się szczepami P.a., których kolonie w hodowli są małe i szorstkie.
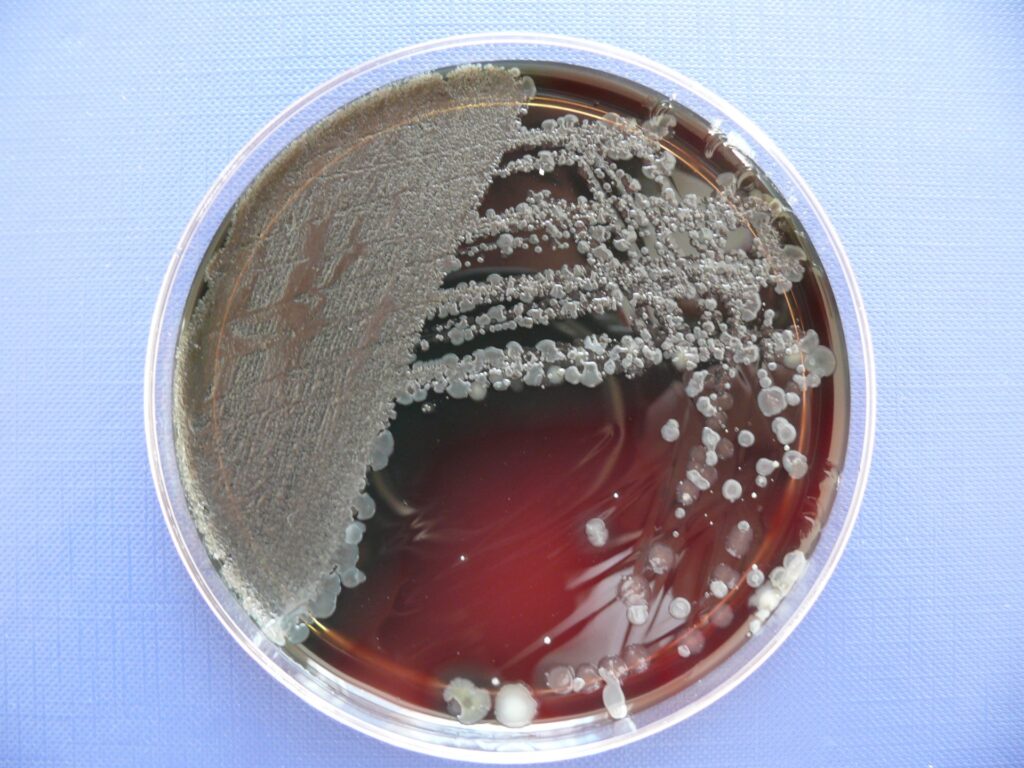
Jednak z czasem, dzięki adaptacji P.a. do warunków w oskrzelach, dochodzi do selekcji bakterii z mutacjami umożliwiającymi wydzielanie substancji zwanej alginianem. Kolonie takiej odmiany P.a. mają wygląd śluzowy.
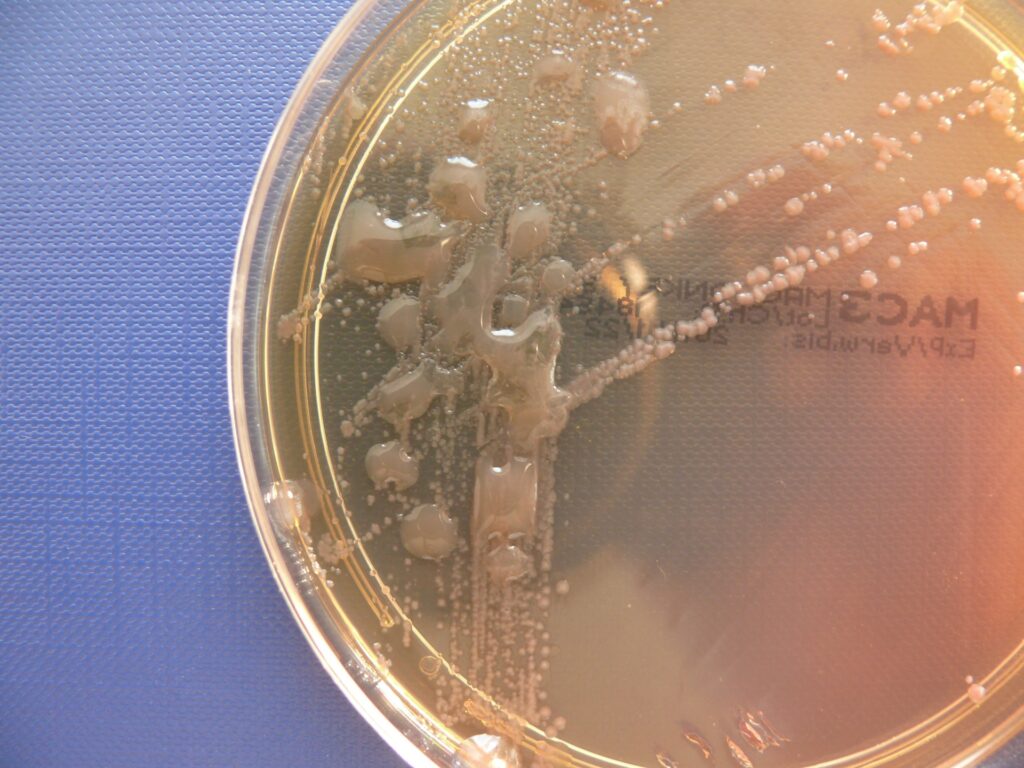
Informacja o wyhodowaniu szczepów śluzowych jest bardzo istotna. Z jednej strony sugeruje, że zakażenie trwa już dłuższy czas, co ma szczególne znaczenie przy pierwszorazowym stwierdzeniu wzrostu P.a. Z drugiej strony informuje o większej oporności wyhodowanych bakterii na antybiotyki. Śluzowa otoczka utrudnia dostęp do bakterii zarówno antybiotykom, jak i komórkom układu odpornościowego. Bakterie z otoczką śluzową rozmnażają się nieco wolniej, a ich procesy życiowe są spowolnione, co dodatkowo zmniejsza ich wrażliwość na stosowane antybiotyki i zmniejsza prawdopodobieństwo eradykacji np. P.a.
Kilka szczepów tego samego gatunku
Zdarza się, że na wyniku badania jest umieszonych kilka szczepów np. Pseudomonas aeruginosa. Często powstają wówczas pytania, czy to, że wyhodowano np. cztery szczepy, jest gorsze dla chorego niż wyhodowanie tylko jednego szczepu?
Warto sobie uświadomić, że posiew np. plwociny wykonuje się z materiału zawierającego bardzo dużą ilość pojedynczych komórek bakteryjnych, np. miliard w 1 ml. Zupełnie naturalne jest, że w takiej masie drobnoustrojów występują między nimi wyraźne różnice. Czasem porównuję plwocinę z jej bakteriami do wystawy zwierząt domowych. Mamy na niej do czynienia z kilkoma gatunkami zwierząt (np. psy, koty, konie), ale z mnóstwem różnych ras, od ratlerka po mastiffa, od sfinksa po mejkuna, od kuca szetlandzkiego po perszerona itd. W przypadku bakterii, np. P.a., również w obrębie jednego gatunku mamy wiele różnych „ras”, nazywanych w mikrobiologii szczepami.
Hodując bakterie w laboratorium, najczęściej uzyskujemy wzrost najliczniejszych i najbardziej żywotnych szczepów z pobranego materiału. Jeżeli są wyraźne różnice w wyglądzie poszczególnych kolonii, wówczas przesiewa się je na oddzielne płytki, traktując jako odrębne szczepy. Typowe jest np. odróżnianie szczepów śluzowych Pseudomonas od szczepów tzw. szorstkich, niepotrafiących produkować alginianu. Poszczególne szczepy mogą się również różnić zabarwieniem kolonii, ich wielkością itd.
Wykazanie wzrostu kilku szczepów w badaniu mikrobiologicznym nie ma prostego przełożenia na stwierdzenie ich większego znaczenia chorobowego. W przypadku stwierdzenia szczepów śluzowych rzeczywiście tak jest. Jednak jeżeli wykaże się wzrost kilku szorstkich szczepów Pseudomonas, wówczas taki wynik nic nie mówi o ich patogenności.
Podstawowym celem oznaczeń poszczególnych szczepów jest uzyskanie informacji o ich lekowrażliwości, która może się wyraźnie różnić. Wówczas planowanie racjonalnej antybiotykoterapii powinno uwzględnić oporność wszystkich wyhodowanych szczepów.
Podsumowanie
Właściwa ocena wyników badań mikrobiologicznych wymaga dużej wiedzy. Do ich ostatecznej interpretacji często nie wystarcza nawet typowe wykształcenie lekarskie, stąd zalecana jest szeroka współpraca z mikrobiologami. Mam jednak nadzieję, że w tej trudnej materii Czytelnicy uzyskali choć częściowe wyjaśnienie najważniejszych wątpliwości. Jeżeli pomimo to czytając wyniki badań swoich lub swojego dziecka, macie Państwo wątpliwości, wówczas proponuję je wyjaśniać z Waszymi lekarzami.