Kiedy w roku 1989 odkryto i sklonowano gen CFTR odpowiedzialny za mukowiscydozę, wydawało się, że w ciągu następnych 5–10 lat uda się dokonać istotnego postępu w leczeniu chorych. Obecnie mija już 27 lat od tego przełomowego odkrycia i nadal nie ma lekarstwa, które pozwoliłoby ostatecznie uwolnić pacjentów od choroby. Niemniej jednak w ostatnim czasie pojawiły się obiecujące możliwości – potencjatory i korektory kanału CFTR, o których pisałem w poprzednim numerze „Mukowiscydozy”. Dziś czas na wiadomości ze świata genetyki.
Co to jest terapia genowa?
Idea terapii genowej jest prosta. Skoro chorobę powoduje mutacja w materiale genetycznym człowieka (DNA), trzeba ten nieprawidłowy fragment wymienić (rys. 1). Jest to tym bardziej uzasadnione, że mukowiscydoza jako choroba monogenowa wynika z błędnej informacji genetycznej tylko dla jednego białka – kanału chlorkowego. Jest to przeciwieństwo do innych chorób, za które odpowiada wiele różnych genów, w dodatku często jeszcze niepoznanych i modyfikowanych przez środowisko (np. nadciśnienie tętnicze). Co więcej, potencjalnie taka wymiana byłaby niezależna od rodzaju mutacji i przynajmniej teoretycznie przyniosłaby ten sam rezultat.
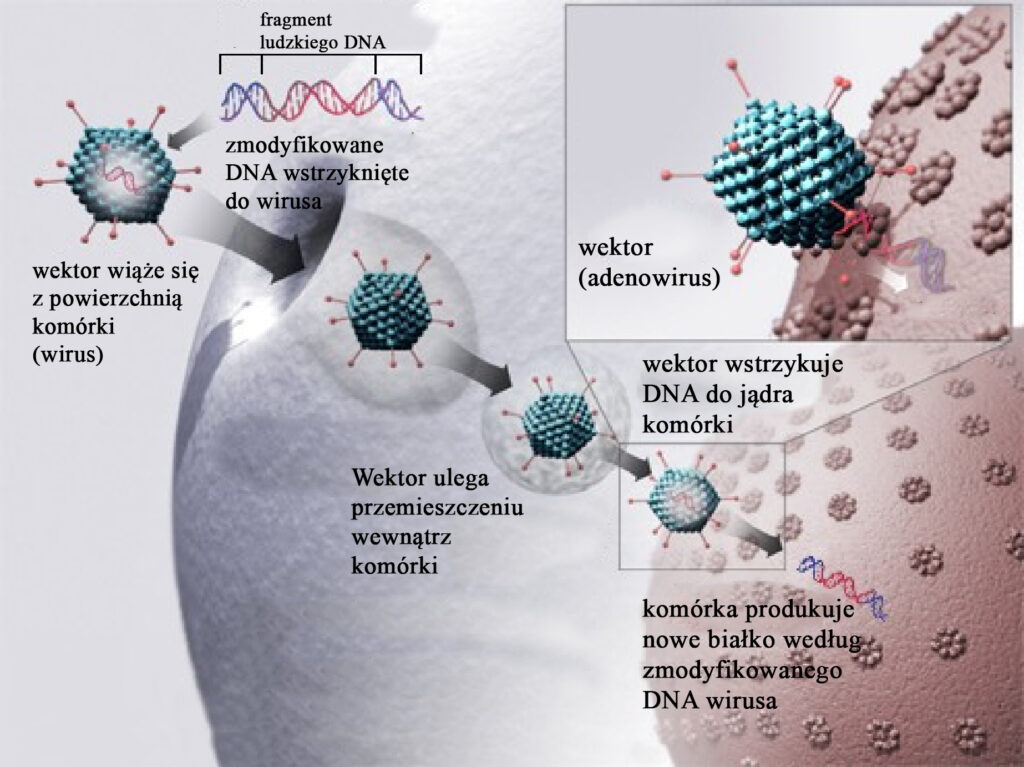
(Wikipedia, modyfikacja własna)
Ile i gdzie?
Pierwsze próby wprowadzenia DNA do ludzkich komórek miały miejsce już w latach 80. XX w., jednak udaną próbę terapii genowej przeprowadzono w maju 1989 roku 1 (rys. 2). Od tego czasu łącznie przeprowadzono aż 2356 różnych badań klinicznych terapii genowej, głównie w USA, w Polsce przeprowadzono do tej pory 6 takich badań. Wśród chorób, które były celem terapii genowej, należy wymienić m.in. wrodzoną ślepotę Lebera, choroideremię, zespół ciężkiego złożonego niedoboru odporności związanego z chromosomem X, adrenoleukodystrofię, białaczkę, szpiczak mnogi, chorobę Parkinsona oraz hemofilię. Obecnie firmy biotechnologiczne przeznaczają setki milionów dolarów na badania laboratoryjne i kliniczne.
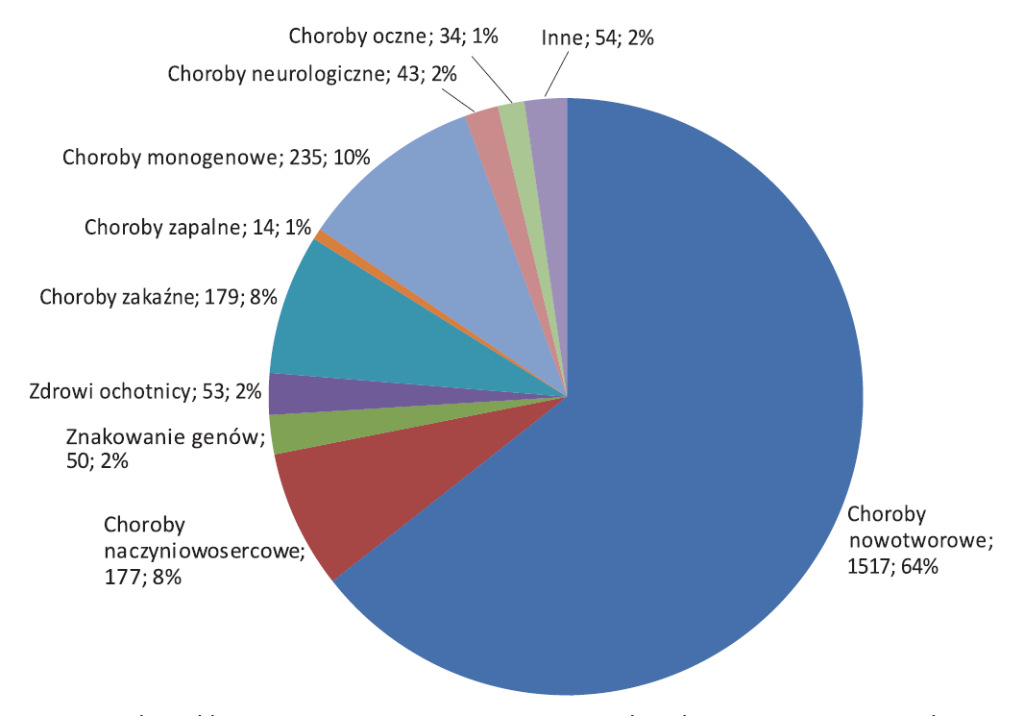
na podstawie http://www.wiley.com/legacy/wileychi/genmed/clinical/)
Konsekwencje terapii
W ludzkim organizmie mamy 2 główne linie komórek – komórki somatyczne (gr. soma, ciało), które budują niemal całego człowieka, oraz komórki germinalne, które dają początek komórkom rozrodczym (plemnikom i komórkom jajowym). Mówiąc o terapii genowej, mamy na myśli przede wszystkim naprawę komórek somatycznych, których zmiany się nie dziedziczy. Terapia komórek rozrodczych skutkowałby przekazywaniem „naprawy genetycznej” kolejnym pokoleniom, co z oczywistych względów budzi wątpliwości moralne i etyczne. Dlatego w krajach takich jak Australia, Kanada, Niemcy, Szwajcaria i Holandia taka terapia jest zakazana. W USA poza ogólnymi regulacjami dotyczącymi leczenia, takiego zakazu nie ma.
Igranie z ogniem
Jak dotychczas na świecie odnotowano 3 zgony z powodu terapii genowej. Do pierwszej w historii śmierci doszło w 1999 r. i dotyczyła 18-letniego Jessego Gelsingera cierpiącego na rzadką chorobę metaboliczną wątroby, występującą także w Polsce (deficyt OTC). Najczęściej deficyt OTC jest dziedziczny i śmiertelny, jednak Jesse miał łagodniejszą postać choroby, gdzie część komórek funkcjonowała prawidłowo, a chłopiec mógł normalnie żyć, stosując dietę i zażywając leki. Pacjent został poddany terapii genowej z użyciem wektora adenowirusowego (czyt. dalej) 13 września 1999 r. Cztery dni później chłopiec zmarł w wyniku uogólnionej reakcji immunologicznej na czynnik wirusowy, który doprowadził do wielonarządowej niewydolności i śmierci mózgu. Historia ta mocno poruszyła środowiskiem naukowców i doprowadziła do spowolnienia dalszych prac nad terapią genową 2. Kolejny zgon miał miejsce w 2003 r. u pacjenta ze złożonym niedoborem odporności z powodu białaczki, a trzeci z powodu infekcji grzybiczej po podaniu wektora AAV.
Biały, czarny i różne odcienie szarości
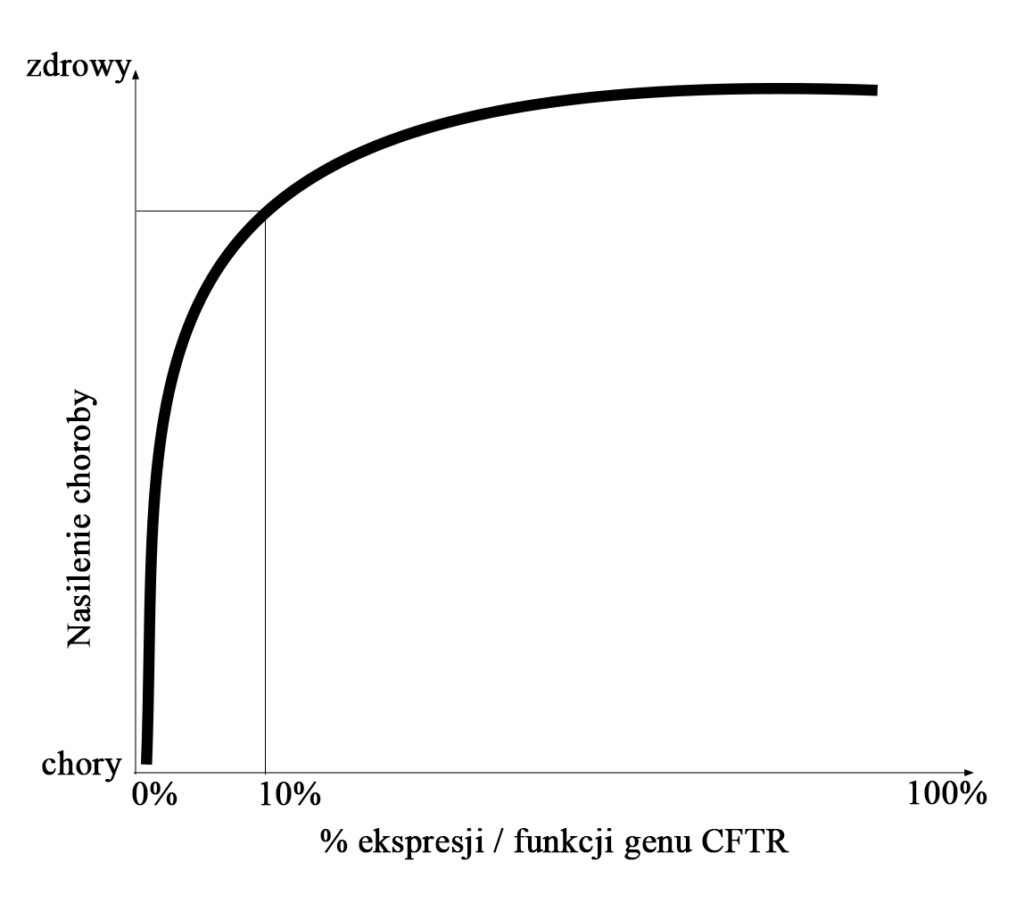
Wiele badań przedklinicznych i klinicznych udowodniło, że idea terapii genowej i poprawa transportu jonów chlorkowych przez błonę jest możliwa do przeprowadzenia. Jednak nadal istnieje pytanie, jak taka korekta przełoży się na czynność płuc. Wiemy, że u pacjentów z łagodniejszymi typami mutacji czynność kanału CFTR wynosi około 10%, czemu towarzyszą objawy ze strony różnych narządów, ale nie układu oddechowego. Być może uleczenie tylko niewielkiego odsetka komórek doprowadziłoby do poprawy funkcji płuc. Takie przypuszczenie zwiększa nadzieje na skuteczność terapii genowej. Z drugiej strony, z badań eksperymentalnych wynika, że aby przywrócić transport śluzoworzęskowy, ekspresja (produkcja) CFTR musi być obecna na poziomie 25%. Jeszcze inne badania wskazują, że do przywrócenia prawidłowego transportu sodu potrzeba aż blisko 100% funkcji CFTR. Czy taka częściowa korekta w działaniu CFTR przyniesie korzyść pacjentom? Na razie jest za wcześnie, aby na to pytanie odpowiedzieć. Prawdopodobną zależność między odsetkiem aktywności CFTR a objawami mukowiscydozy przedstawia rys. 3.
Wymienić gen, ale jak?
Podstawowym problemem w terapii genowej jest przeniesienie prawidłowego genu CFTR do jądra komórkowego, gdzie nowy materiał ulegnie odczytaniu i przepisaniu na łańcuch białka (kanał jonowy). Droga ta jest długa i dość skomplikowana, a sam sposób podania leku – problematyczny. Najczęściej leki podaje się drogą dożylną, jednak w przypadku terapii genowej w mukowiscydozie chodzi przede wszystkim o podanie leku do komórek nabłonka dróg oddechowych, bo tam tkwi główny problem. Dlatego wydaje się, że najlepszą drogą jest terapia wziewna lub podanie bezpośrednie do nosa lub tchawicy. Jednak to nie wszystko. Barierę stanowi wydzielina dróg oddechowych, gęsty śluz, biofilm bakteryjny, naturalne mechanizmy obronne układu odpornościowego (przeciwciała, nieswoiste substancje takie jak mucyna), błona komórkowa, otoczka jądrowa oraz mechanizmy niszczenia wewnątrzkomórkowego, które bronią dostępu do materiału genetycznego w komórce (tabela 1 i tabela 2). Choć istnieje obecnie metoda bezpośredniego podania DNA do jądra komórkowego, nie da się tego zrobić w skali całego układu oddechowego. Pozostaje więc podanie leku na przykład w postaci wziewnej, mając nadzieję, że lek zdoła wejść do jądra komórkowego.
Tabela 1. Przeszkody w transferze DNA do nabłonka dróg oddechowych
| Bariery na zewnątrz komórki |
|
| Bariery wewnątrz komórki |
|
Tabela 2. Przeszkody terapii genowej
|
Podanie czystego DNA raczej skazane jest na porażkę, dlatego do transportu genu wykorzystuje się swoiste nośniki zwane wektorami (ang. gene transfer agents). Wektory te należą do 2 grup: wektory wirusowe i wektory niewirusowe.
Wirusy do roboty
Z biologicznego punktu widzenia wirusy nie są organizmami żywymi 3, a jedynie połączeniem nici kwasu nukleinowego (DNA lub RNA) z kilkoma białkami. Dzięki sprytnym rozwiązaniom potrafią niepostrzeżenie dostać się do wnętrza komórki i wykorzystać komórkowe mechanizmy produkcji własnego materiału genetycznego i własnych białek. Część wirusów potrafi wiązać się z ludzkim DNA, część ulega ekspresji (odczytaniu) w obrębie jądra komórkowego lub cytoplazmy. Do najczęściej wykorzystywanych wektorów należą adenowirusy (Ad), wirusy towarzyszące adenowirusom (AAV), wirus Sendai (SeV) oraz lentiwirusy.
Wektory wirusowe mają kilka zalet. Lepiej niż wektory niewirusowe „wchodzą” do komórek gospodarza, potrafią też lepiej wykorzystać mechanizmy tworzenia kopii materiału genetycznego i na dłużej łączyć się z genomem gospodarza. Jednocześnie stanowi to pewne zagrożenie (ryzyko trwałych zmian w ludzkim DNA).
Z kolei wektory niewirusowe można produkować na dużą skalę, są mniej immunogenne 4, ale także mniej efektywne (tak zwana transfekcja). Do metod terapii genowej z wykorzystaniem niewirusowych wektorów należą wstrzyknięcia nagiego DNA, elektroporacja, działo genowe, sonoporacja, transfekcja w polu magnetycznym, użycie oligonukletoydów i nieorganicznych nanocząstek oraz kilka innych.
Wektory adenowirusowe były zastosowane jako pierwsze w terapii genowej w mukowiscydozie. Początkowe badania wykorzystywały wektory Ad z usuniętym regionem E1, który jest niezbędny do namnażania się wirusa. Kolejne generacje wektorów zostały „ogołocone” z kolejnych białek, tak aby były jeszcze bardziej bezpieczne dla chorego. Wektory Ad nie łączą się z ludzkim DNA, pozostają jednak w otoczeniu jądra, gdzie jest możliwa ich ekspresja. Naturalnie adenowirusy wywołują infekcje górnych dróg oddechowych, dlatego wykazują szczególną zdolność (tak zwany tropizm) do zakażenia komórek nabłonka dróg oddechowych. Pierwsze próby z zastosowaniem tych wektorów polegały na podaniu wirusów donosowo.
Obecnie prowadzone są zaawansowane badania nad wykorzystywaniem wektorów niewirusowych 5, które są bezpieczniejsze od odmian wirusowych. Dokonuje się również skomplikowanych modyfikacji genetycznych, tak aby jak najdłużej umożliwiały produkcję prawidłowych kanałów jonowych CFTR. Postęp w pracach nad efektywnością wektorów prezentuje rys. 4.
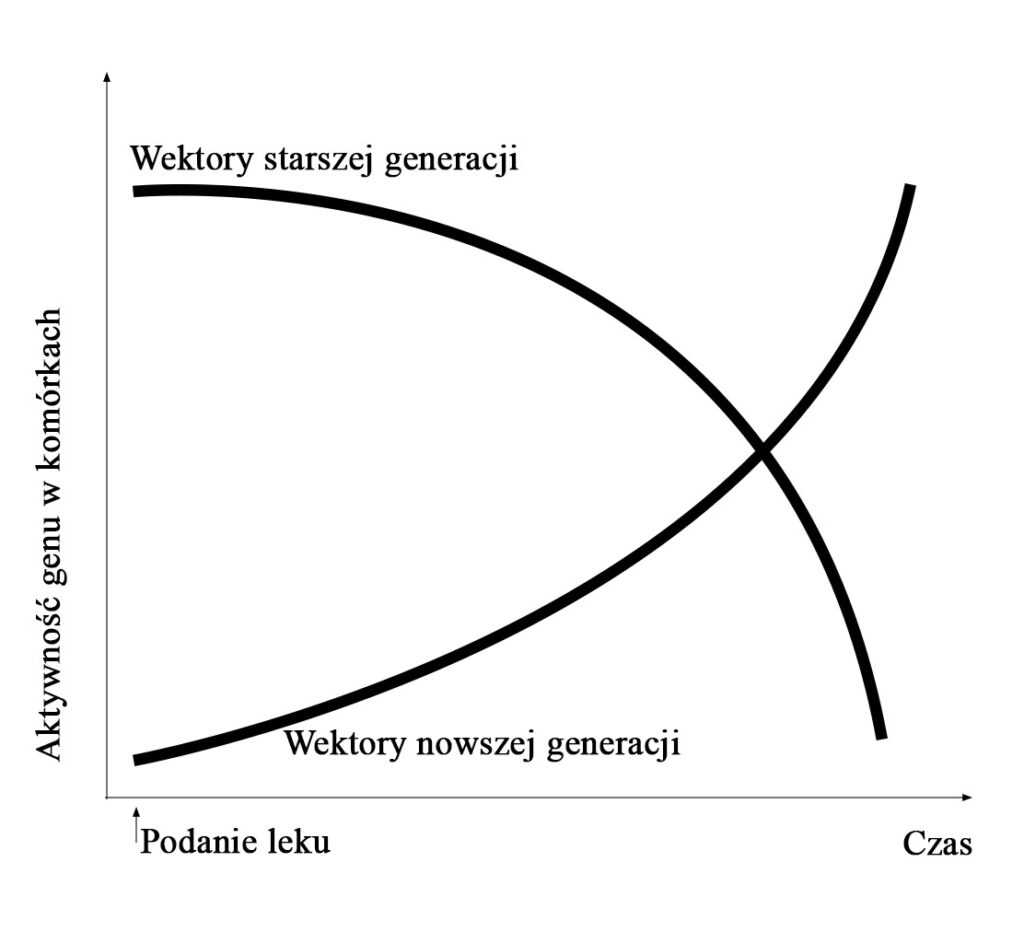
Hodson, Geddes Cystic fibrosis 2016 w modyfikacji własnej)
Badania kliniczne
Dla każdego pacjenta chorego na mukowiscydozę zawsze najważniejsze pozostaje pytanie, jaka jest skuteczność leku i jakiego efektu klinicznego można oczekiwać. Niestety, odpowiedź na tak postawione pytanie nie jest prosta. Mimo że dotychczas przeprowadzono 26 badań klinicznych z udziałem łącznie 450 chorych na mukowiscydozę, większość z nich została zaprojektowana w celu udowodnienia słuszności koncepcji terapii genowej i jej bezpieczeństwa, a nie w celu określenia znaczenia klinicznego 6. Pierwsze badania kliniczne opierały się na podaniu wektorów do nabłonka nosa jako tkanki najbardziej przypominającej nabłonek oskrzeli i płuc. Badania te pozwoliły ukazać mocne i słabe strony stosowanych technik oraz fakt, że dość trudno przewidzieć efekty kliniczne takich terapii.
Już w 1993 r., czyli 4 lata po sklonowaniu genu CFTR, przeprowadzono małe badanie kliniczne na 3 chorych z mukowiscydozą. Kolejne 9 badań pokazało, że wektory Ad są mało efektywne w przenoszeniu prawidłowej kopii genu CFTR i wywołują odpowiedź immunologiczną przy kolejnych próbach podania leku. Od drugiej połowy lat 90. XX w. odnotowuje się dość szybki rozwój badań nad wekorami AVV, jednak i one nie spełniły oczekiwań. Jedno z badań z udziałem 100 chorych nie potwierdziło poprawy funkcji płuc 7. Na razie brak jest doniesień na temat prób klinicznych zastosowania innych wektorów wirusowych.
W roku 2000 brytyjscy naukowcy zaprezentowali nowe podejście. Udowodnili, że 3-krotne donosowe podawanie wektora niejonowego jest możliwe bez utraty skuteczności leczenia 8. Tym niewirusowym wektorem była liposomowa cząsteczka połączona z ludzkim DNA zamkniętym w pierścień (tak zwany plazmid). Rok wcześniej na łamach prestiżowego tygodnika Lancet przedstawiono pierwsze badanie z wykorzystaniem podobnego niejonowego wektora w postaci nebulizacji do płuc. Było to badanie randomizowane, kontrolowane placebo na 16 chorych, gdzie wykazano elektrofizjologiczną poprawę w układzie oddechowym w grupie, która otrzymała lek 9. Doświadczenie wykazało również, że lek wywołuje jedynie przejściowy umiarkowany stan zapalny, w przeciwieństwie do wcześniej stosowanych wektorów. Badanie zostało powtórzone w 2001 r. z podobnymi wynikami.
W lipcu 2015 opublikowano kolejne badanie randomizowane z kontrolą placebo, tym razem z udziałem 140 chorych na mukowiscydozę w wieku powyżej 12 lat oraz z FEV1 10 w granicach 50–90% wartości należnej, u których zastosowano formułę pGM169/GL67A w postaci nebulizacji powtarzanych co 4 tygodnie przez okres roku 11 (zdjęcie 1). Pierwszorzędnym punktem końcowym była zmiana wartości FEV1. Po roku leczenia w grupie badanej średni spadek tego parametru wyniósł 0,4% w porównaniu z 4% w grupie kontrolnej. Jak do tej pory jest to pierwsze na świecie badanie, które udowodniło umiarkowaną, ale istotną statystycznie poprawę funkcji płuc mierzoną badaniami czynnościowymi z zastosowaniem terapii genowej.
Leki w innych chorobach
Pierwszy komercyjnie dostępny lek terapii genowej o nazwie Gendicine został dopuszczony do stosowania w Chinach w 2003 r. i obejmował wskazaniem raka płaskonabłonkowego głowy i szyi. W 2011 r. w Rosji zarejestrowano lek Neovasculgen stosowany do leczenia choroby tętnic obwodowych, w tym krytycznego niedokrwienia kończyn. W 2012 r. w Europie zarejestrowano lek o nazwie Glybera (substancja alipogenetiparvovec), który jest stosowany w leczeniu rodzinnej chylomikronemii (niedobór lipazy lipoproteinowej LPL) prowadzącej do groźnych zapaleń trzustki, cukrzycy, a nawet zgonu. Schorzenie jest niezwykle rzadkie (częstość występowania 1–2 przypadki na 1 mln), co utrudnia prowadzenie badań nad jego skutecznością oraz znacznie podnosi koszty. W 2015 r. szacowany koszt terapii dla jednego pacjenta wynosił 1 milion dolarów i wówczas był to najdroższy dostępny lek na świecie.
Lek Glybera podaje się w jednorazowej sesji składającej się z kilkudziesięciu wstrzyknięć w mięśnie nóg. Aby zapobiec reakcji obronnej organizmu przeciw wektorowi, przez 12 tygodni podaje się lek immunosupresyjny. Glybera wykorzystuje wektor AAV, aby przenieść prawidłową kopię genu LPL. Wektor wirusowy nie wywołuje choroby, wchodzi jedynie do komórek niedzielących się i wywołuje niewielką reakcję cytotoksyczną organizmu. Dotychczas lek będący w III fazie badań klinicznych zastosowano u 27 chorych 12.
Podsumowanie
W ciągu najbliższych kilku lat będziemy świadkami dwóch trendów. Z jednej strony świat nauki pójdzie w kierunku potencjatorów i korektorów CFTR (leki nazwie Kalydeco, Orcambi), które już w tej chwili są wykorzystywane w leczeniu. Drugi trend to terapia genowa, która obecnie wydaje się być ciut za nowymi lekami, jednak badanie kliniczne z 2015 r. jest bardzo obiecujące i niewykluczone, że terapia genowa wkrótce wyprze potencjatory i korektory CFTR. Z doniesień prasowych wynika, że brytyjskie konsorcjum CFGTC dokłada wszelkich starań, aby tak właśnie się stało.
Bibliografia
- Alton E.W. et al., Cationic lipidmediated CFTR gene transfer to the lungs and nose of patients with cystic fibrosis: a doubleblind placebo-controlled trial. Lancet, 1999, 353 (9157), s. 947–954.
- Alton E.W. et al., Repeated nebulisation of nonviral CFTR gene therapy in patients with cystic fibrosis: a randomised, doubleblind, placebo-controlled, phase 2b trial. Lancet Respir Med, 2015, 3 (9), s. 684–691.
- Griesenbach U. and E.W. Alton, Moving forward: cystic fibrosis gene therapy. Hum Mol Genet, 2013, 22 (R1), s. R52–58.
- Hyde S.C. et al., Repeat administration of DNA/liposomes to the nasal epithelium of patients with cystic fibrosis. Gene Ther, 2000, 7 (13), s. 1156–1165.
- Moss R.B. et al., Repeated Aerosolized AAV-CFTR for Treatment of Cystic Fibrosis: A Randomized Placebo-Controlled Phase 2B Trial. Human Gene Therapy, 2007, 18(8), s. 726–732.
- Rosenberg S.A. et al., Gene transfer into humans – immunotherapy of patients with advanced melanoma, using tumorinfiltrating lymphocytes modified by retroviral gene transduction. N Engl J Med, 1990, 323 (9), s. 570–578.
- Scott L.J., Alipogene Tiparvovec: A Review of Its Use in Adults with Familial Lipoprotein Lipase Deficiency, Drugs, 2015, 75 (2), s. 175–182.
- Sibbald B., Death but one unintended consequence of genetherapy trial. CMAJ: Canadian Medical Association Journal, 2001, 164 (11), s. 1612.
Przypisy
- Rosenberg S.A. et al., Gene transfer into humans – immunotherapy of patients with advanced melanoma, using tumorinfiltrating lymphocytes modified by retroviral gene transduction. N Engl J Med, 1990, 323 (9), s. 570–578. ↩︎
- Sibbald B., Death but one unintended consequence of genetherapy trial. CMAJ: Canadian Medical Association Journal, 2001, 164 (11), s. 1612. ↩︎
- Choć posiadają pewne ich cechy (przyp. autora). ↩︎
- Reakcja odpornościowa jest słabsza (przyp. autora). ↩︎
- Głównie przez U.K. Cystic Fibrosis Gene Therapy Consortium – CFGTC. ↩︎
- Griesenbach U. and E.W. Alton, Moving forward: cystic fibrosis gene therapy. Hum Mol Genet, 2013, 22 (R1), s. R52–58. ↩︎
- Moss R.B. et al., Repeated Aerosolized AAV-CFTR for Treatment of Cystic Fibrosis: A Randomized Placebo-Controlled Phase 2B Trial. Human Gene Therapy, 2007, 18(8), s. 726-732. ↩︎
- Hyde S.C. et al., Repeat administration of DNA/liposomes to the nasal epithelium of patients with cystic fibrosis. Gene Ther, 2000, 7 (13), s. 1156–1165. ↩︎
- Alton E.W. et al., Cationic lipidmediated CFTR gene transfer to the lungs and nose of patients with cystic fibrosis: a doubleblind placebo-controlled trial. Lancet, 1999, 353 (9157), s. 947-954. ↩︎
- Natężona objętość wydechowa pierwszosekundowa. ↩︎
- Alton E.W. et al., Repeated nebulisation of non-viral CFTR gene therapy in patients with cystic fibrosis: a randomised, doubleblind, placebo-controlled, phase 2b trial. Lancet Respir Med, 2015, 3 (9), s. 684–691. ↩︎
- 12 Scott L.J., Alipogene Tiparvovec: A Review of Its Use in Adults with Familial Lipoprotein Lipase Deficiency, Drugs, 2015, 75 (2), s. 175–182. ↩︎