Stan odżywienia, mimo że w ostatnich latach uległ znacznej poprawie, nadal stanowi fundamentalny element w leczeniu osób chorych na mukowiscydozę (1). Głównym argumentem jest fakt, że optymalny stan odżywienia predysponuje do lepszego przebiegu choroby podstawowej. Zmiany w masie ciała niezaprzeczalnie korelują z prowadzoną dietą i bilansem energetycznym, natomiast coraz częściej zwraca się również uwagę na rolę aktywności fizycznej oraz jej wpływ na stan odżywienia i zdrowia pacjentów z mukowiscydozą.
Stan odżywienia
Stan odżywienia według definicji jest to stan zdrowia warunkowany zwyczajowym sposobem żywienia, przebiegiem procesów trawienia, wchłaniania i wykorzystania składników odżywczych oraz oddziaływania na te procesy czynników patologicznych (2). W mukowiscydozie obserwuje się zwiększone zapotrzebowanie energetyczne, zaburzenia wchłaniania, infekcje czy choroby towarzyszące, które mają wpływ na niedobory masy ciała (3, 4, 5). Czynniki ryzyka niedożywienia w grupie pacjentów z mukowiscydozą przedstawiono na ryc. 1. W praktyce klinicznej dąży się do uzyskania optymalnego stanu odżywienia pacjenta, co odpowiada (6, 7):
- 50 percentylowi parametru proporcji masy do długości ciała w grupie niemowląt i małych dzieci do 2 r.ż. (siatki centylowe WHO),
- 50 percentylowi parametru BMI w grupie dzieci i młodzieży 2–18 lat (siatki centylowe OLA, OLAF),
- BMI o wartości 22–27 kg/m² w grupie dorosłych kobiet oraz 23–27 kg/m² w grupie dorosłych mężczyzn.
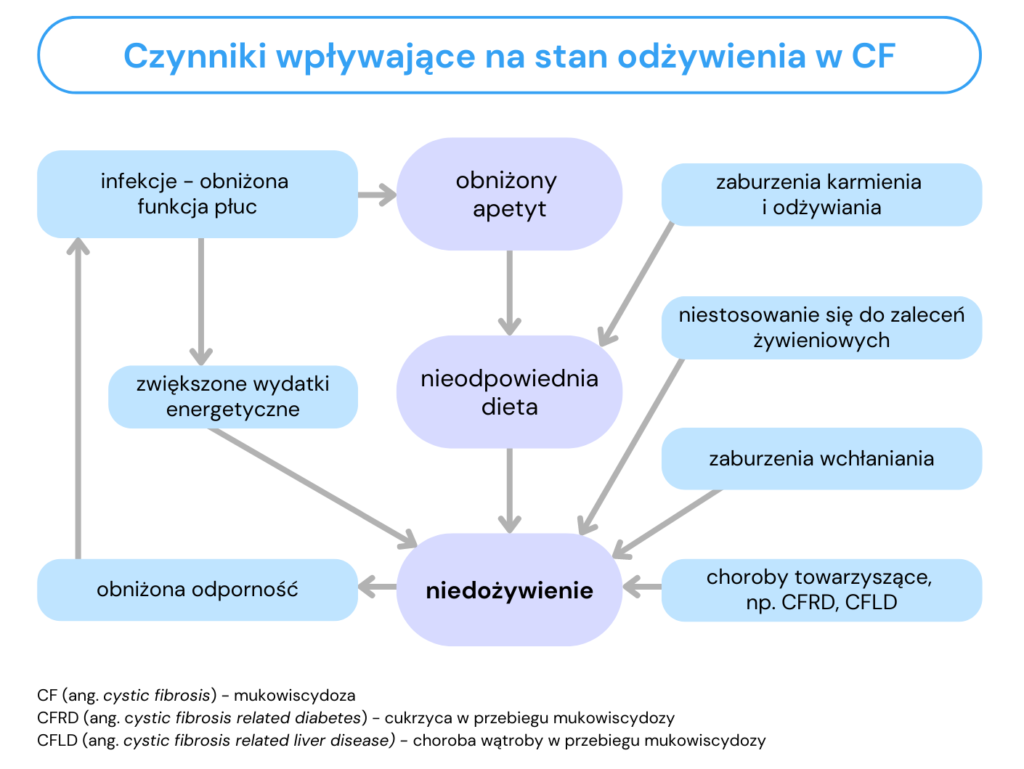
Ryc. 1. Czynniki wpływające na stan odżywienia w mukowiscydozie na podstawie „Mukowiscydoza – choroba wieloukładowa” (5)
Warto jednak zaznaczyć, że wskaźnik masy ciała (BMI) jako samodzielny parametr nie jest idealny, gdyż nie uwzględnia składu ciała pacjenta. Nie pozwala zatem na wykrycie np. ubytku masy mięśniowej czy nadmiaru tkanki tłuszczowej, w tym otyłości przy normalnej masie ciała NWO (ang. normal weight obesity), obserwowanej również u osób chorujących na mukowiscydozę (8, 9).
Aktualnie istnieje kilka metod pozwalających na analizę i ocenę składu ciała: impedancja bioelektryczna (BIA – ang. bioelectrical impedance analysis, bioimpedancja elektryczna), dwuwiązkowa absorpcjometria rentgenowska (DXA lub DEXA, ang. dual-energy X-ray absorptiometry), a także tomografia komputerowa, rezonans magnetyczny czy ultrasonografia (1). W praktyce klinicznej (poza podstawowymi pomiarami antropometrycznymi, takimi jak pomiar masy i wysokości lub długości ciała) najczęściej wykorzystywaną metodą spośród wymienionych jest analiza składu ciała metodą BIA.
Natomiast sam skład ciała to nic innego jak składające się na ludzki organizm poszczególne komponenty – można wyróżnić dwa podstawowe: tkankę tłuszczową (FM, ang. fat mass) oraz beztłuszczową masę ciała (FFM, ang. fat-free mass) (10). Szczegółowy podział składu ciała zilustrowano na ryc. 2 (1).
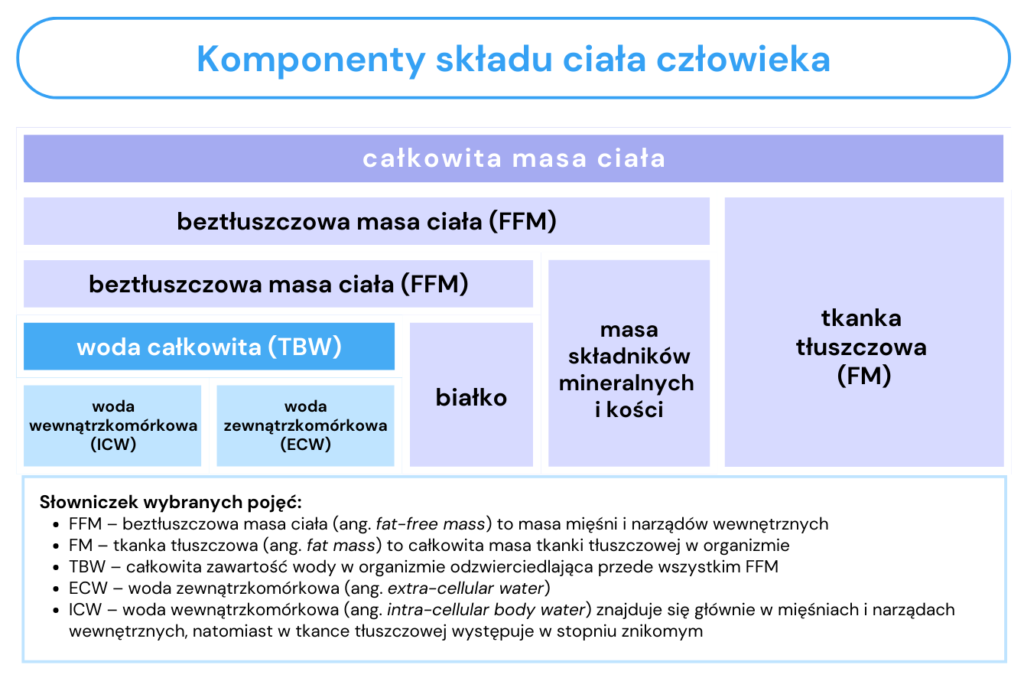
Ryc. 2. Komponenty składu ciała człowieka na podstawie „Ocena stanu odżywienia w mukowiscydozie – nowe wyzwania”. Mukowiscydoza 2022, nr 63 (1)
Stan odżywienia a stan zdrowia
Nieprawidłowy stan odżywienia (zarówno niedobór, jak i nadmiar masy ciała, a także odchylenia w składzie ciała) może wykazywać negatywny wpływ na stan zdrowia oraz przebieg choroby podstawowej. Jak przedstawiono na ryc. 1, mukowiscydoza niesie za sobą przede wszystkim ryzyko niedożywienia. Niedobór masy ciała jest najczęstszym przedmiotem interwencji dietetycznych i niekorzystnie oddziałuje na prawidłowy rozwój dzieci i młodzieży, funkcję płuc, częstotliwość hospitalizacji czy oczekiwaną długość życia w tej grupie pacjentów (5, 8).
W ostatnich latach wśród chorych na mukowiscydozę obserwowany jest wzrost częstości nadwagi oraz otyłości (w tym otyłości „ukrytej” NWO przebiegającej z prawidłową całkowitą masą ciała przy jednocześnie ponadnormatywnym udziale tkanki tłuszczowej) (9). W badaniach jednego z amerykańskich ośrodków leczenia mukowiscydozy wykazano, że aż 25% dorosłych pacjentów (w tym z „ciężkimi” mutacjami) miało nadwagę bądź otyłość (11). Nadmiar masy ciała w społeczeństwie aktualnie to problem globalny, a sama otyłość według Światowej Organizacji Zdrowia (WHO) stała się epidemią XXI w. Należy zwrócić uwagę również na fakt, że otyłość jest już chorobą przewlekłą samą w sobie, wpisaną na listę Międzynarodowej Klasyfikacji Chorób (ICD-10) pod numerem E66. Stanowi główny czynnik zespołu metabolicznego, a do jej powikłań można zaliczyć m.in. zaburzenia gospodarki węglowodanowej (w tym cukrzycę typu II) i lipidowej (choroby układu krążenia) (12, 13).
W badaniach wykazano, że w grupie pacjentów chorych na mukowiscydozę nadmiar tkanki tłuszczowej (FM) może niekorzystnie oddziaływać na stężenie glukozy na czczo, wrażliwość tkanek na insulinę oraz indukować insulinooporność. Z kolei większy udział beztłuszczowej masy ciała (FFM) sprzyja poprawie funkcji płuc oraz lepszej gęstości mineralnej kości, a jej deficyt może powodować (1):
- negatywy wpływ na przebieg choroby podstawowej,
- osłabienie siły mięśni oddechowych,
- pogorszenie funkcji płuc,
- zwiększenie ryzyka zaostrzenia choroby oskrzelowo-płucnej,
- nasilenie stanu zapalnego,
- wydłużenie czasu i (lub) częstotliwości hospitalizacji.
Wspomniana wcześniej analiza składu ciała jest więc dobrą metodą do oceny i monitorowania stanu odżywienia pacjentów oraz prognozowania jego wpływu na ogólny stan zdrowia, a także przebieg choroby podstawowej.
Aktywność fizyczna
Możemy wyróżnić dwie podstawowe formy aktywności fizycznej: aerobowa (tlenowa) oraz oporowa (siłowa). Wysiłek aerobowy, zwany też wytrzymałościowym lub treningiem „cardio”, polega na utrzymaniu przez dłuższy czas rytmicznej aktywności dużych grup mięśniowych, przyspiesza tętno i oddech oraz poprawia wytrzymałość. Do tego typu ćwiczeń fizycznych zalicza się m.in. energiczny marsz, bieganie, skakanie na skakance, jazda na rowerze, taniec czy gra w piłkę nożną lub koszykówkę. Z kolei głównym celem treningu oporowego jest wzmocnienie siły mięśni, a najpopularniejszy przykład takiej aktywności to podnoszenie ciężarów. Należy przy tym zaznaczyć, że „budowę” masy mięśniowej można uzyskać też poprzez podnoszenie ciężarków (hantli) o mniejszym obciążeniu, za pomocą opasek oporowych, maszyn lub ciężaru własnego ciała (np. pompki, przysiady czy tzw. „deska”, ang. plank). Wspinaczka czy joga również przyczyniają się do zwiększenia udziału FFM w składzie ciała (14). Dodatkowo można wyróżnić także trening gibkości: statyczny (znany bliżej jako „rozciąganie”, ang. stretching) oraz dynamiczny (polegający na powolnym ruchu obejmującym pełny zakres w danym stawie). Trening gibkości pozwala zwiększyć zakres ruchu w stawach, poprawia równowagę i stabilność postawy, a najlepsze efekty przynosi w połączeniu z treningiem oporowym (15).
Inną kategorią aktywności ruchowej, poza celowymi treningami, stanowi spontaniczna aktywność fizyczna (NEAT, ang. nonexercise activity thermogenesis). Jest to wydatek energetyczny związany z codzienną, spontaniczną aktywnością, taką jak chodzenie, stanie, chodzenie po schodach, sprzątanie, zabawa z dzieckiem czy inne czynności związane z życiem codziennym. Nawet nieplanowana aktywność fizyczna o niskiej intensywności wpływa na wydatek i bilans energetyczny, może więc zatem przyczyniać się do redukcji masy ciała i przeciwdziałać występowaniu nadwagi i otyłości (16).
Ogólne zalecenia dotyczące aktywności fizycznej dla populacji zdrowej (dzieci, młodzieży i dorosłych) przedstawiono w tab. 1 (15, 17).
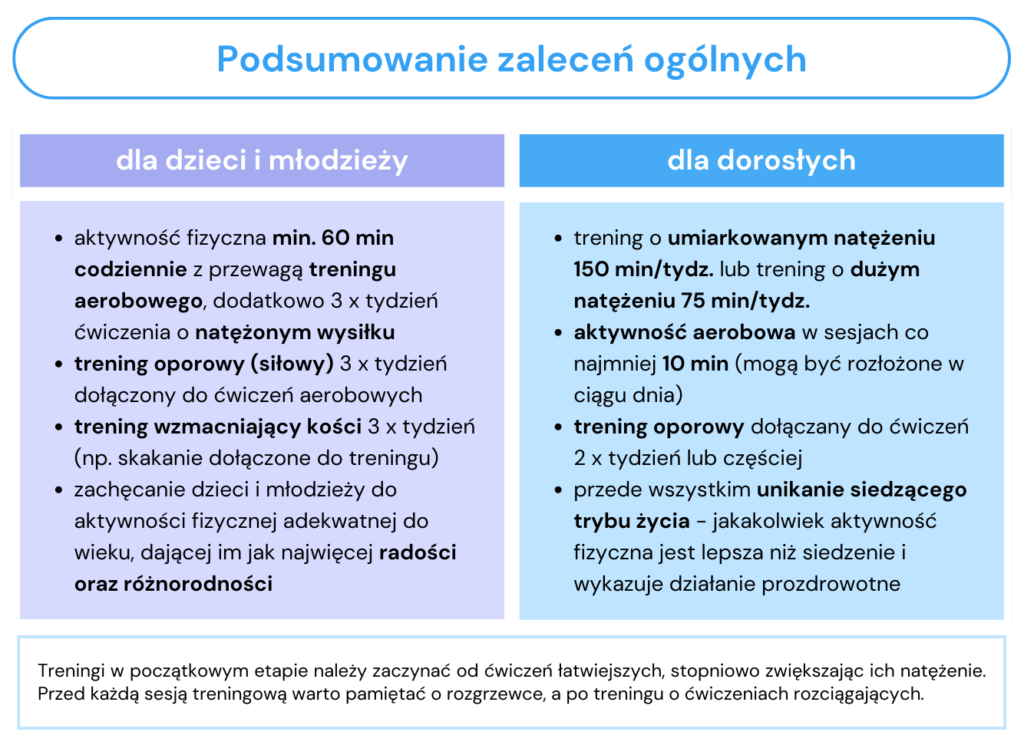
Tab. 1. Podsumowanie zaleceń ogólnych dotyczących aktywności fizycznej dla populacji zdrowej (dzieci, młodzież i dorośli) na podstawie zaleceń Narodowego Centrum Edukacji Żywieniowej (15, 17)
Warto jednak zaznaczyć, że aktywność fizyczna zawsze powinna być dobierana indywidualnie z uwzględnieniem stanu zdrowia, stanu odżywienia, stopnia wytrenowania i możliwości pacjenta, a także osobniczych preferencji – najlepiej po uprzedniej konsultacji z lekarzem prowadzącym, fizjoterapeutą i dietetykiem.
Aktywność fizyczna a stan odżywienia
Regularna aktywność fizyczna w połączeniu z prawidłowo zbilansowaną dietą może przyczynić się do redukcji całkowitej masy ciała i jest podstawowym narzędziem w profilaktyce oraz leczeniu nadwagi i otyłości. Ponadto wysiłek fizyczny pozytywnie wpływa na skład ciała poprzez przyrost zawartości beztłuszczowej masy ciała i masy mięśniowej oraz redukcję tkanki tłuszczowej. Takie zjawisko sprzyja lepszej gęstości mineralnej kości (profilaktyka osteoporozy) czy poprawie parametrów związanych z zaburzeniami tolerancji glukozy. W grupie pacjentów z mukowiscydozą poprawa stanu odżywienia i składu ciała przynosi korzyści również w walce z chorobą podstawową, co ilustruje ryc. 3.

Ryc. 3. Wpływ aktywności fizycznej na stan odżywienia oraz stan zdrowia osób chorych na mukowiscydozę (1)
Dodatkowo ćwiczenia fizyczne oraz codzienny ruch nie tylko pozytywnie wpływają na stan odżywienia, ale także pomagają radzić sobie ze stresem, rozładowują napięcie psychiczne i poprawiają samopoczucie (17).
Aktywność fizyczna – potencjalne ryzyko
Pomimo że wysiłek fizyczny wykazuje wiele korzystnych efektów zdrowotnych, to niesie za sobą również pewne ryzyko. Niewłaściwy dobór treningu (np. zbyt forsowny) czy też niedostosowanie diety do indywidualnego zapotrzebowania i wzmożonego wysiłku może w rezultacie prowadzić do niedoborów pokarmowych, odwodnienia, hipoglikemii, kontuzji, a także dolegliwości ze strony układu pokarmowego (18, 19).
W populacji ogólnej wraz z intensyfikacją jednostek treningowych obserwuje się wzrost częstości występowania zaburzeń czynnościowych jelit. Wśród głównych czynników sprzyjających takim zaburzeniom wymienić można kluczowy dla właściwej motoryki jelit spadek przepływu przez nie krwi (nawet o 80% podczas maksymalnego wysiłku lub bezpośrednio po nim), zaburzenia elektrolitowe związane z odwodnieniem oraz zaburzenia mikrobioty jelitowej. Dodatkowo efekt ten może zostać spotęgowany poprzez niewłaściwą dietę, nadmierne przyjmowanie leków z grupy niesteroidowych leków przeciwzapalnych (NLPZ) czy zjawisko stresu oksydacyjnego, który towarzyszy intensywnej pracy mięśni. Główne dolegliwości ze strony układu pokarmowego podczas lub po forsownym treningu (zawodach) to ból i dyskomfort brzucha, refluks, nudności, wymioty czy biegunka. Zdarzają się także krwawienia z przewodu pokarmowego, których częstość występowania oraz nasilenie rośnie wraz z intensywnością wykonywanego wysiłku. Dodatkowo u niektórych zawodników obserwowana jest zwiększona podatność na infekcje. W celu zmniejszenia ryzyka wystąpienia ww. objawów w okresie wzmożonej aktywności fizycznej istotnymi są odpowiednia dieta, właściwe nawodnienie, racjonalizacja planu treningowego oraz zapewnienie odpowiedniej przerwy regeneracyjnej (18, 20). W grupie pacjentów z mukowiscydozą należy zwrócić szczególną uwagą na skład jakościowy posiłku przedtreningowego, bowiem posiłek wysokotłuszczowy spożyty bezpośrednio przed wysiłkiem może powodować opóźnione opróżnianie żołądka, a w konsekwencji dyskomfort i dolegliwości ze strony układu pokarmowego podczas ćwiczeń (21).
Innym niekorzystnym zjawiskiem obserwowanym w grupie osób aktywnych fizycznie jest przewlekle niska dostępność energii (LEA, ang. low energy availability) stanowiąca podstawową przyczynę zespołu RED-S (względny niedobór energii w sporcie, ang. relative energy deficiency in sport). Zespół ten dotyczy zarówno kobiet, jak i mężczyzn trenujących zawodowo lub rekreacyjnie. Zespół RED-S jest następstwem niedostatecznej podaży kalorii z diety przy jednocześnie zwiększonym zapotrzebowaniu energetycznym w związku ze wzmożoną aktywnością fizyczną (ujemny bilans energetyczny). Międzynarodowy Komitet Olimpijski (MKOI) wyszczególnił grupę potencjalnych konsekwencji zdrowotnych występujących wskutek niedoboru energii, co przedstawiono na ryc. 4.
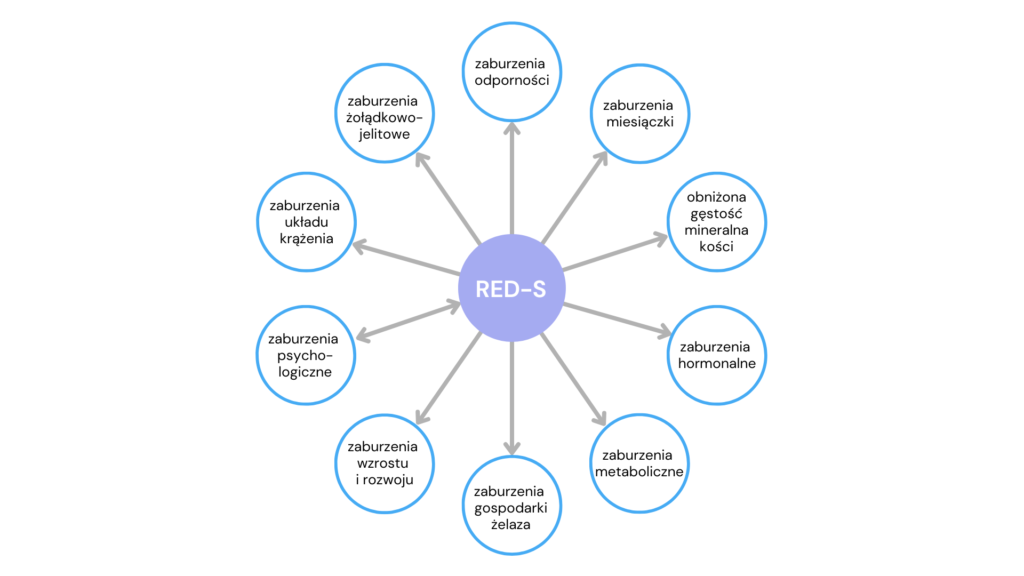
Ryc. 4. Konsekwencje zdrowotne niskiej dostępności energii (RED-S) wg. MKOI (2018)
Wskazane zaburzenia niosą za sobą z kolei negatywne efekty podczas treningów i zawodów w postaci: obniżenia poziomu glikogenu, siły mięśni i wytrzymałości, pogorszenia odpowiedzi treningowej oraz zdolności oceny sytuacji, zmniejszonej koordynacji i koncentracji, a co za tym wszystkim idzie – zwiększonego ryzyka kontuzji. Niska podaż energii może sprzyjać także wzmożonej drażliwości oraz depresji (19). Zespół RED-S to zbiór zaburzeń występujący w populacji ogólnej, natomiast należy pamiętać o jego konsekwencjach w przypadku osób chorujących na mukowiscydozę, u których deficyt energetyczny jest dodatkowo pogłębiony wskutek przebiegu choroby podstawowej.
Postępowanie dietetyczne w mukowiscydozie – zalecenia ogólne
W oparciu o aktualne zalecenia żywieniowe (5) kaloryczność diety osób chorych na mukowiscydozę może wynosić 110–200% energii w porównaniu do zdrowych rówieśników tej samej płci, z czego białko powinno stanowić 20%, tłuszcz 35–40%, a węglowodany 40–45%. Pacjenci z mukowiscydozą wymagają także zwiększonej podaży soli, a często również dodatkowej suplementacji witamin A, D, E, K. Najczęściej zalecaną dietą w tej grupie pacjentów jest więc dieta wysokokaloryczna, wysokobiałkowa ze zwiększonym dosalaniem, przy czym zawsze należy pamiętać o indywidualizacji zaleceń w zależności m.in. od aktualnego stanu odżywienia (niedowaga lub niedożywienie, ale też nadwaga lub otyłość), wieku, płci, aktywności fizycznej czy chorób współistniejących (np. CFRD).
Strategie żywieniowe i nawodnienie
W grupie osób aktywnych fizycznie, poza ogólnymi zasadami żywienia, warto zastosować dodatkowo strategie żywienia okołotreningowego uwzględniające rodzaj, czas i częstotliwość oraz intensywność ćwiczeń fizycznych. Międzynarodowe Towarzystwo Żywienia w Sporcie (ang. International Society of Sports Nutrition) wyszczególniło kilka punktów, mających za zadanie wsparcie treningów (zawodów) oraz okresu regeneracji wśród sportowców:
- Odpowiednia energetyczność diety oraz podaż białka (w każdym posiłku co 3–4 godz.).
- Odpowiednia podaż węglowodanów sprzyjająca gromadzeniu się zapasów glikogenu mięśniowego i wątrobowego.
- Żywienie okołotreningowe:
- posiłek przed- i (lub) potreningowy (węglowodanowo-białkowy lub białkowy) – może korzystnie wpływać na zwiększenie siły oraz poprawę składu ciała; podaż białka tuż po lub do 2 godz. po treningu, ale też bezpośrednio przed ćwiczeniami stymuluje syntezę białek mięśniowych (MPS, ang. muscle protein synthesis),
- posiłek treningowy (węglowodanowy lub białkowo-węglowodanowy) oraz uzupełnianie elektrolitów wskazane podczas długotrwałego treningu (> 90 min) o wysokiej intensywności (> 70% VO2max) (22).
Posiłek przedtreningowy oparty na węglowodanach odpowiada zatem za zapasy energii. Im bliżej do treningu (zawodów), tym bardziej płynne powinny być spożywane produkty. Posiłek treningowy węglowodanowy (ewentualnie węglowodanowo-białkowy) stanowi z kolei uzupełnienie zapasów energii podczas długich, intensywnych sesji treningowych – wtedy też należy zadbać o uzupełnienie elektrolitów. Posiłek potreningowy ma zadanie regeneracyjne: węglowodany proste odpowiadają za odbudowę glikogenu, natomiast białko za regenerację i wzrost tkanki mięśniowej. Podczas zawodów lepiej spożywać znane posiłki i produkty wypróbowane podczas treningów, co pozwoli zawodnikowi na uczucie komfortu po posiłku i uniknięcie dolegliwości ze stronu układu pokarmowego. Podczas każdej aktywności fizycznej należy pamiętać o odpowiednim nawodnieniu – do picia najlepsza jest naturalna woda mineralna (wypijana równomiernie w ciągu dnia, a także podczas treningów) (14).
Pacjenci chorujący na mukowiscydozę podczas wzmożonego wysiłku mają dodatkowo zwiększone zapotrzebowaniu na chlorek sodu (sól). Z kolei osoby z zaburzeniami tolerancji glukozy powinny tak zaplanować treningi, rozkład i rodzaj posiłków, aby zapobiegać ewentualnym epizodom hipoglikemii, oraz w razie potrzeby zmodyfikować dawki inuliny, jeżeli jest stosowana (6).
Podsumowanie
Optymalny stan odżywienia zarówno w kontekście wartości parametru BMI, jak i składu ciała jest jednym z głównych celów postępowania żywieniowego u osób chorych na mukowiscydozę. Wysiłek fizyczny w połączeniu z prawidłowo zbilansowaną dietą wykazuje korzystny wpływ na stan odżywienia oraz stan zdrowia pacjentów, sprzyja bowiem przyrostom beztłuszczowej masy ciała (FFM) oraz redukcji tkanki tłuszczowej (FM). W grupie pacjentów aktywnych fizycznie możemy więc spodziewać się pozytywnego wpływu na przebieg choroby podstawowej, w tym zwiększenia siły mięśni oddechowych, poprawy funkcji płuc, niższego ryzyka zaostrzenia choroby oskrzelowo-płucnej czy skrócenia czasu i (lub) częstotliwości hospitalizacji, a także lepszej gęstości mineralnej kości oraz poprawy wrażliwości tkanek na działanie insuliny. Każdy plan żywieniowo-treningowy powinien być zindywidualizowany i dostosowany do potrzeb pacjenta. Przed rozpoczęciem treningów warto skonsultować się z lekarzem, fizjoterapeutą i dietetykiem w celu uzyskania najlepszych efektów oraz uniknięcia potencjalnego ryzyka w postaci niedoborów pokarmowych, kontuzji czy dolegliwości ze strony układu pokarmowego.
Bibliografia
- Madej P., Mielus M. Ocena stanu odżywienia w mukowiscydozie – nowe wyzwania. Mukowiscydoza 2022, nr 63.
- Charzewska J. Ocena stanu odżywienia. [w:] Żywienie człowieka. Podstawy nauki o żywieniu. Gawęcki J., Hryniewiecki L. (red). PWN, Warszawa, 2010: 529– 5433.
- Calella P., Valerio G., Brodlie M. i in. Cystic fibrosis, body composition, and health outcomes: a systematic review. Nutrition. 2018 Nov; 55–56: 131–139.
- Turck D., Braegger C.P., Colombo C. i in. ESPEN-ESPGHAN-ECFS guidelines on nutrition care for infants, children, and adults with cystic fibrosis. Clin Nutr. 2016 Jun; 35 (3): 557–577.
- Mukowiscydoza – choroba wieloukładowa, praca zbiorowa pod red. D. Sands, Termedia Wydawnictwa Medyczne, Poznań, 2021.
- Saxby N. i in. Nutrition Guidelines for Cystic Fibrosis in Australia and New Zealand. Bell S, editor. Sydney: Thoracic Society of Australia and New Zealand, 2017.
- Mielus M., Walicka-Serzysko K., Sands D. Rozpoznawanie i leczenie mukowiscydozy. Podsumowanie wytycznych European Cystic Fibrosis Society 2018. Medycyna Praktyczna, 2019, nr 6.
- King S.J., Nyulasi I.B, Boyd J.G. i in. Fat-free mass depletion in cystic fibrosis: Associated with lung disease severity but poorly detected by body mass index. Nutrition. Jul–Aug 2010; 26 (7–8): 753–759.
- Alvarez J.A., Ziegler T.R , Millson E.C. i in. Body composition and lung function in cystic fibrosis and their association with adiposity and normal-weight obesity. Nutrition. 2016 Apr; 32 (4): 447–452.
- Mańko M. Wykorzystanie właściwości elektrycznych tkanek w pomiarach biomedycznych metodą impedancji bioelektrycznej. Prace doktorantów Politechniki Lubelskiej – 2020, Lublin, 2020.
- Harindhanavudhi T., Wang Q., Dunitz J. i in. Prevalence and factors associated with overweight and obesity in adults with cystic fibrosis: A single-center analysis. J Cyst Fibros. 2020 Jan; 19 (1): 139–145.
- Olszanecka-Glinianowicz M., Stoś K., Gajda-Wyrębek J. Stanowisko Polskiego Towarzystwa Badań nad Otyłością, Narodowego Instytutu Zdrowia Publicznego – Państwowego Zakładu Higieny, Instytutu Żywności i Żywienia im. prof. dra med. Aleksandra Szczygła w sprawie stosowania niskokalorycznych substancji słodzących. Nutrition, Obesity & Metabolic Surgery 2019; 6, 1: 1–6.
- Jarosz M. (red.): Normy żywienia dla populacji Polski i ich zastosowanie, Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, Warszawa, 2020.
- Bean A. Żywienie w sporcie. Kompletny przewodnik. Wydawnictwo Zysk i S-ka, Poznań, 2014.
- Plucik-Mrożek A., Perl M., Prochownik M. Aktywność fizyczna dorosłych. Narodowe Centrum Edukacji Żywieniowej, Narodowy Instytut Zdrowia Publicznego PZH – Państwowy Instytut Badawczy, https://ncez.pzh.gov.pl/wp-content/uploads/2021/03/aktywnosc-fizyczna-doroslych.pdf (dostęp 30.09.2022).
- Chung N., Park M.Y., Kim J. i in. Non-exercise activity thermogenesis (NEAT): a component of total daily energy expenditure. J Exerc Nutrition Biochem. 2018; 22 (2): 023–030.
- Plucik-Mrożek A., Perl M., Prochownik M. Aktywność fizyczna dzieci i młodzieży. Narodowe Centrum Edukacji Żywieniowej, Narodowy Instytut Zdrowia Publicznego PZH – Państwowy Instytut Badawczy, https://ncez.pzh.gov.pl/wp-content/uploads/2021/03/aktywnosc-fizyczna-dzieci-i-mlodziezy.pdf (dostęp 30.09.2022).
- Marlicz W. Wysiłek fizyczny a mikroflora przewodu pokarmowego – znaczenie probiotyków w diecie sportowców. Forum Zaburzeń Metabolicznych 2014; 5, 129–140.
- Mountjoy M., Sundgot-Borgen J.K., Burke L.M. i in. IOC consensus statement on relative energy deficiency in sport (RED-S): 2018 update. Br J Sports Med., 2018 Jun; 52 (11): 687–697.
- Kęska A. Zadbaj o swoje jelita – zacznij się świadomie ruszać! Narodowe Centrum Edukacji Żywieniowej. https://ncez.pzh.gov.pl/aktywnosc-fizyczna/zadbaj-o-swoje-jelita-zacznij-sie-swiadomie-ruszac (dostęp 09.10.2022).
- Kench A., Selvadurai H. Chapter 36 – Diet, Food, Nutrition, and Exercise in Cystic Fibrosis. In: Watson RR, editor. Diet and Exercise in Cystic Fibrosis. Boston: Academic Press, 201, 317–332.
- Kerksick C.M., Wilborn C.D., Roberts M.D. i in. ISSN exercise & sports nutrition review update: research & recommendations. Journal of the International Society of Sports Nutrition, 2018; 15 (1): 38.