Stan odżywienia osób chorujących na mukowiscydozę uległ znacznej poprawie na przestrzeni ostatnich dekad, co z kolei korzystnie wpłynęło m.in. na rozwój dzieci i młodzieży, poprawę funkcji płuc czy oczekiwaną długość życia w tej grupie pacjentów (1). Należy jednak pamiętać, że zwiększone zapotrzebowanie energetyczne, zaburzenia wchłaniania, infekcje, choroby towarzyszące oraz niedostateczna podaż energii i składników odżywczych w diecie nadal stanowią istotne czynniki ryzyka niedożywienia u pacjentów z CF (2, 3). Z drugiej strony nieprawidłowy stan odżywienia to nie tylko niedożywienie i niedobór masy ciała, ale także jej nadmiar oraz nieprawidłowości w składzie ciała. Występowanie nadwagi i otyłości, także wśród dzieci, aktualnie stanowi problem globalny i występuje na całym świecie (4).
Otyłość – zdefiniowana przez Światową Organizację Zdrowia (WHO) jako epidemia XXI wieku – jest chorobą przewlekłą charakteryzującą się zwiększeniem masy ciała poprzez wzrost udziału tkanki tłuszczowej w składzie ciała (5), obciążoną licznymi powikłaniami (głównie cukrzycą typu II i zaburzeniami układu krążenia) oraz stanowiącą główny czynnik zespołu metabolicznego (6, 7). Kluczowe przyczyny sprzyjające nadmiernej masie ciała to nieprawidłowe nawyki żywieniowe (ilościowe – dodatni bilans energetyczny diety, jakościowe – m.in. zbyt wysoka podaż cukrów prostych czy żywności przetworzonej) oraz niedostateczna aktywność fizyczna (6).
W ostatnich latach problem nadmiernej masy ciała – nadwagi i otyłości, a także otyłości przy normalnej masie ciała NWO (normal weight obesity) – obserwuje się również u osób chorych na mukowiscydozę (8). Nadwaga lub otyłość dotyczyła 25% chorych wśród dorosłych pacjentów z amerykańskiego ośrodka leczenia mukowiscydozy, również tych z „ciężkimi” mutacjami (9).
Otyłość przy normalnej masie ciała, jak sama nazwa wskazuje, jest otyłością w pewnym sensie ukrytą – charakteryzującą się nadmiarem tkanki tłuszczowej przy jednocześnie prawidłowym wskaźniku masy ciała (BMI). Pomiar masy i wysokości ciała, w tym obliczenie BMI, są więc niewystarczające do oceny faktycznego stanu odżywienia pacjenta z NWO czy ubytkiem masy mięśniowej (1). W takiej sytuacji wskazana jest analiza składu ciała, która stanowi dobre narzędzie do określenia zawartości poszczególnych komponentów, takich jak: tkanka tłuszczowa (FM), beztłuszczowa masa ciała (FFM) czy całkowita zawartość wody (TBW) w organizmie.
Metody oceny stanu odżywienia
Oceny stanu odżywienia aktualnie można dokonać różnorodnymi technikami – poprzez standardowe pomiary antropometryczne (m.in. pomiar masy i długości/ wysokości ciała) czy za pomocą analizy składu ciała metodami impedancji bioelektrycznej (BIA), dwuwiązkowej absorpcjometrii rentgenowskiej (DXA), a także bardziej zaawansowanymi, jak np. tomografia komputerowa, rezonans magnetyczny, ultrasonografia czy metody izotopowe (10, 11).
Podstawowe pomiary antropometryczne
Zgodnie z obowiązującymi rekomendacjami europejskimi z zakresu opieki żywieniowej niemowląt, dzieci i dorosłych z mukowiscydozą (3) złoty standard oceny stanu odżywienia pacjentów z CF nadal stanowią podstawowe pomiary antropometryczne (pomiary masy i wysokości/ długości ciała) wykonywane w regularnych odstępach czasu. Tak uzyskane dane pozwalają na:
- ocenę proporcji masy do długości ciała (dzieci <2 lat) lub BMI (dzieci >2 lat, młodzież i dorośli),
- ocenę aktualnego stanu odżywienia pacjenta,
- monitorowanie trendów stanu odżywienia w określonych odstępach czasu,
- spersonalizowaną opiekę dietetyczną oraz wprowadzanie odpowiednich interwencji żywieniowych w zależności od stanu odżywienia pacjenta.
Wskaźnik masy ciała BMI to nic innego jak stosunek masy ciała (w kilogramach) do wysokości ciała (w metrach do kwadratu) wyrażany w jednostce kg/m2, pozwalający na ogólną ocenę stanu odżywienia. Dodatkowo w grupie pediatrycznej podstawowe narzędzie do oceny antropometrycznej stanowią siatki centylowe umożliwiające kontrolę rozwoju fizycznego dziecka oraz wykrywanie odchyleń, takich jak: zaburzenia wzrastania, ubytki masy ciała czy ryzyko nadwagi i otyłości (12). W tab. 1 przedstawiono klasyfikację stanu odżywienia osób chorych na mukowiscydozę w oparciu o wybrane wartości (13, 14).
Tab. 1. Klasyfikacja stanu odżywienia osób chorych na mukowiscydozę w oparciu o wybrane wartości
| Stan odżywienia | Dzieci <2 lat | Dzieci i młodzież
2–18 lat | Dorośli |
|---|---|---|---|
| optymalny | proporcja masy do długości ciała: >50 centyla | BMI: 50–85 centyl (CDC) lub BMI: 50–91 centyl (WHO) | kobiety: BMI 22–27 kg/m²
mężczyźni: BMI 23–27 kg/m² |
| akceptowalny | proporcja masy do długości ciała: 25–50 centyl | BMI: 25–50 centyl | kobiety: BMI 20–22 kg/m²
mężczyźni: BMI 20–23 kg/m² |
| nieodpowiedni – ryzyko niedożywienia | proporcja masy do długości ciała: 10–25 centyl | BMI: 10–25 centyl | BMI <20 kg/m² |
| zwiększone BMI | nie dotyczy, ale wskazane jest stosowanie siatek centylowych celem monitorowania gwałtownych przyrostów masy ciała | nadwaga BMI: 85–95 centyl (CDC) lub BMI: >91–98 centyla (WHO)otyłość BMI: >95 centyla (CDC) lub BMI: >98 centyla (WHO) | BMI >27 kg/m² |
Impedancja bioelektryczna (BIA)
Analiza składu ciała metodą impedancji bioelektrycznej (BIA – bioelectrical impedance analysis, bioimpedancja elektryczna) polega na pomiarze oporu elektrycznego tkanek poprzez przepuszczenie przez nie prądu o niskim natężeniu – całkowicie bezpiecznym i praktycznie nieodczuwalnym dla osoby zakwalifikowanej do badania. Opór elektryczny to inaczej impedancja, składa się z rezystancji i reaktancji tkanek miękkich i jest zależny od ich budowy – m.in. od zawartości wody czy tłuszczu (11), a jak wiadomo z ogólnych praw fizyki to właśnie woda odpowiada zazwyczaj za przewodnictwo prądu.
Organizm ludzki składa się przede wszystkim z wody, która stanowi ok. 70% całkowitej masy ciała dorosłego człowieka. Zawartość ta jest jednak zmienna i zależna od czynników, takich jak:
- wiek (noworodki cechują się wyższą zawartością wody w organizmie niż osoby starsze),
- płeć (woda stanowi 50–55% masy ciała kobiet i 60–65% masy ciała mężczyzn),
- dieta (ilość i jakość spożywanych pokarmów, podaż wody i soli),
- aktywność fizyczna (wzmożona nasila utratę wody z organizmu),
- temperatura otoczenia (wyższa nasila utratę wody z organizmu),
- choroby i przyjmowane leki (np. leki diuretyczne, czyli moczopędne, mogą nasilać utratę wody z organizmu).
W dużym uproszczeniu można przyjąć, że ciało człowieka dzieli się na dwa kluczowe komponenty: tkankę tłuszczową i beztłuszczową masę ciała (15). Tkanka tłuszczowa składa się z trójglicerydów oraz lipidów, nie zawiera natomiast wody, która stanowi za to większą część (ok. 72–74%) beztłuszczowej masy ciała. Szczegółowy podział na poszczególne składowe ciała ilustruje tab. 2. Odmienna budowa tkanki tłuszczowej i beztłuszczowej masy ciała powoduje różnice w przewodzeniu prądu elektrycznego, co z kolei umożliwia przeprowadzenie analizy składu ciała metodą BIA (11). Dokładność oszacowania zawartości wody w zależności od urządzenia waha się w okolicach 1,5%. Pomiar reaktancji (oporu biernego) służy do określania masy komórkowej. Relacja pomiędzy rezystancją a reaktancją określa tzw. kąt fazowy, kąt ten rośnie ze wzrostem ilości błon komórkowych, a maleje, gdy zwiększa się ilość tłuszczu, białek oraz wody z elektrolitami. Analizator we współpracy z oprogramowaniem komputerowym, po wprowadzeniu danych takich jak wiek, płeć, wzrost, aktywność fizyczna, jest w stanie oszacować podstawowe informacje o składzie ciała. Przykładowy wydruk przedstawiający wynik badania składu ciała oceniany za pomocą BIA przedstawia ryc. 1.
Tab. 2. Komponenty składu ciała (15)
| Całkowita masa ciała | ||||
|---|---|---|---|---|
| Beztłuszczowa masa ciała (FFM) | Tkanka tłuszczowa (FM) | |||
| Masa mięśniowa | Masa składników mineralnych i kości | |||
| Woda całkowita (TBW) | Białko | |||
| Woda wewnątrzkomórkowa (ICW) | Woda zewnątrzkomórkowa (ECW) | |||
Słowniczek wybranych pojęć (11,16):
- FFM – beztłuszczowa masa ciała (free fat mass) to masa mięśni i narządów wewnętrznych,
- FM – tkanka tłuszczowa (fat mass) to całkowita masa tkanki tłuszczowej w organizmie,
- TBW – całkowita zawartość wody w organizmie odzwierciedlająca przede wszystkim FFM,
- ECW – woda zewnątrzkomórkowa (extra-cellular water),
- ICW – woda wewnątrzkomórkowa (intra-cellular body water) znajduje się głównie w mięśniach i narządach wewnętrznych, natomiast w tkance tłuszczowej występuje w stopniu znikomym.
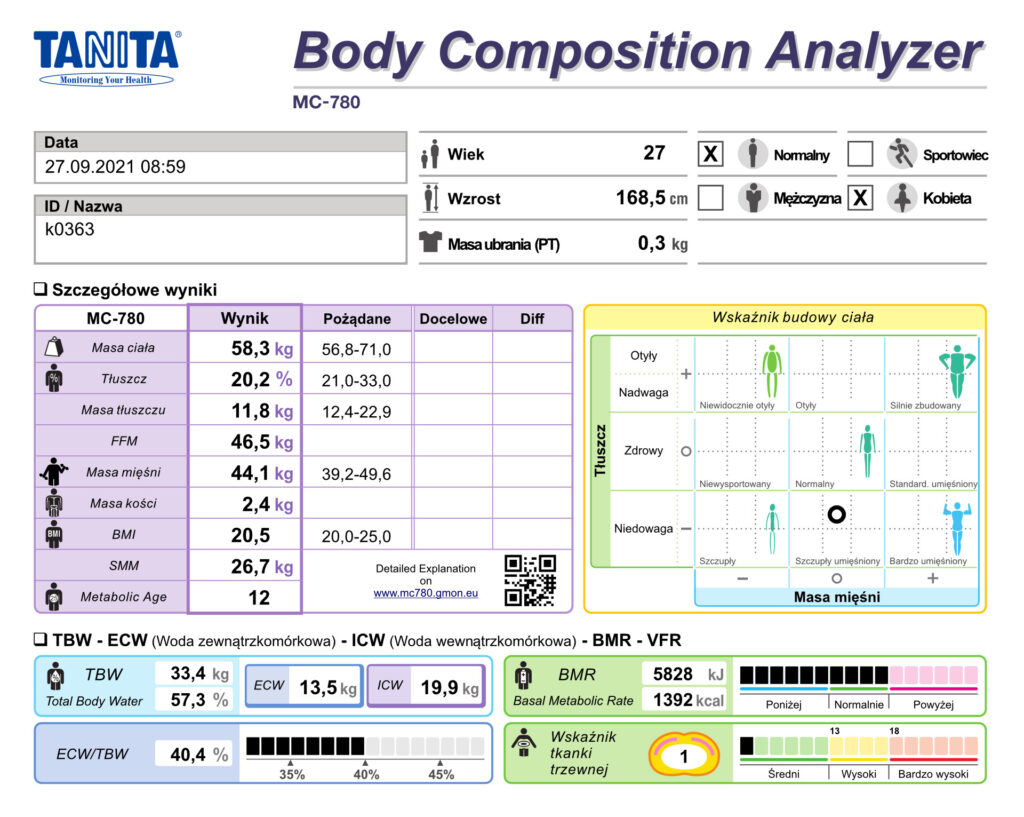
Ryc. 1. Przykładowy fragment analizy składu ciała metodą BIA (źródło własne, TANITA MC-780)
Prawidłowe warunki przeprowadzenia analizy składu ciała, przeciwwskazania oraz zalety metody bioimpedancji elektrycznej BIA przedstawiono w tab. 3. W zależności od stosowanego modelu analizatora składu ciała ograniczeniem może być również wysokość ciała pacjenta – szczególnie u dzieci (zbyt niska wysokość ciała i/lub za mała wielkość stopy może uniemożliwić prawidłowe wykonanie badania składu ciała).
Tab. 3. Prawidłowe warunki, przeciwwskazania i zalety analizy składu ciała metodą BIA (10, 11, 17)
| Warunki prawidłowego przeprowadzenia badania | Przeciwwskazania do badania | Zalety badania |
|---|---|---|
|
|
|
Inne metody służące do oceny składu ciała
Dwuwiązkowa absorpcjometria rentgenowska (DXA) to metoda densytometryczna pozwalająca na ocenę gęstości i zawartości mineralnej kości, a także tłuszczowej oraz beztłuszczowej masy ciała (17). Badanie jest dokładne, nieinwazyjne i bezpieczne – stosowane dawki promieniowania rentgenowskiego są niewielkie. Limitacją do wykorzystywania badania densytometrycznego w monitorowaniu składu ciała jest jego dostępność oraz wymóg odpowiedniego wysokospecjalistycznego sprzętu wraz z radiologicznie wykwalifikowanym personelem (10, 18).
Tomografia komputerowa, rezonans magnetyczny czy ultrasonografia to z kolei metody czasochłonne, kosztowne i wymagające także wysoko wykwalifikowanego personelu medycznego. W badaniu tomografii komputerowej wykorzystuje się ponadto promieniowanie rentgenowskie, co dyskwalifikuje tę metodę jako narzędzie do regularnego monitorowania stanu odżywienia (10, 18). Badania te nie są zatem stosowane w codziennej praktyce klinicznej w celach antropometrycznych.
Jaką metodę wybrać?
Podczas doboru metody antropometrycznej należy kierować się wieloma czynnikami, takimi jak: wiek i stan pacjenta, dostępność do narzędzi oraz wykwalifikowanego personelu, a także częstotliwość oceny stanu odżywienia oraz inne badania z wykorzystaniem promieniowania rentgenowskiego w celu uniknięcia nadmiernej ekspozycji na to promieniowanie.
Referencyjną metodą antropometryczną pozwalającą na ocenę składu ciała jest dwuwiązkowa absorpcjometria rentgenowska (DXA). Jednak ze względu na ograniczony dostęp do tego narzędzia w wielu ośrodkach metodą z wyboru w codziennej praktyce klinicznej może więc być metoda impedancji bioelektrycznej (BIA). W monitorowaniu składu ciała najbardziej korzystnie jest dokonywanie pomiarów w odstępach czasu, które pozwalają na śledzenie trendu (ryc. 2).
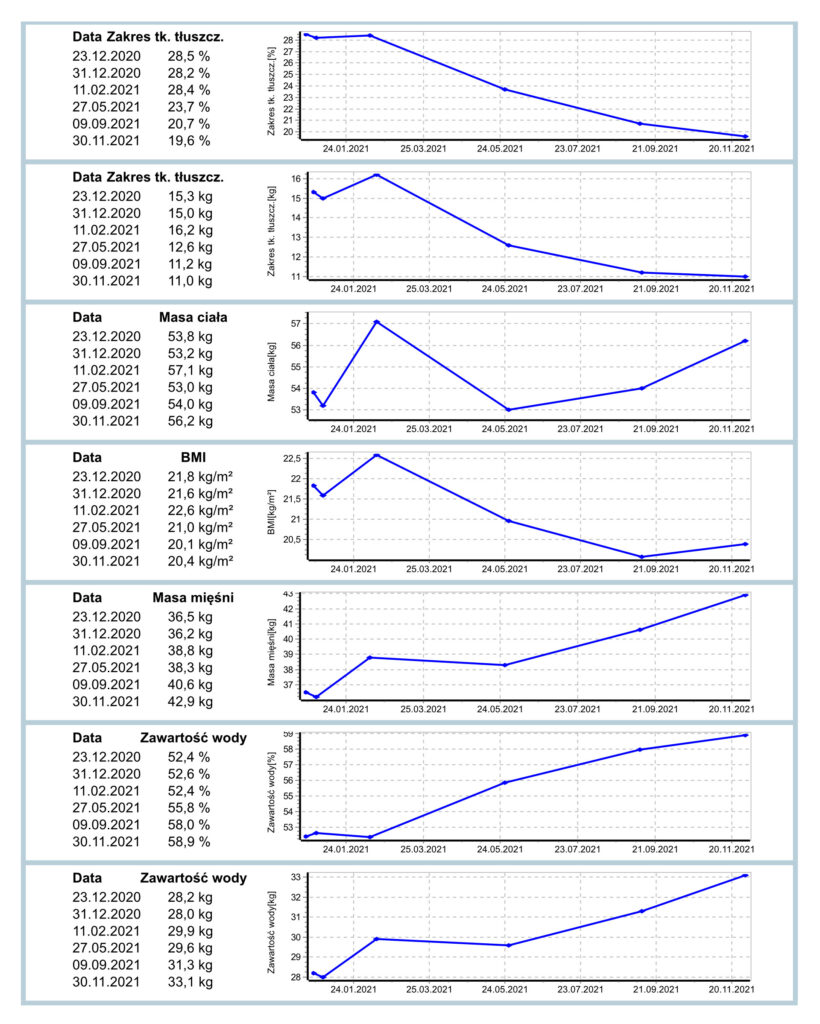
Ryc. 2. Przykładowy fragment rocznych trendów składu ciała na podstawie BIA (źródło własne, TANITA MC-780). Na wskazanych trendach stanu odżywienia zaobserwować można m.in. tendencję wzrostową masy mięśniowej przy jednoczesnym spadku zawartości tkanki tłuszczowej w organizmie w skali roku – mimo obniżenia wartości BMI skład ciała uległ poprawie.
Skład ciała: dlaczego jest taki ważny?
Badania wykazały związek między składem ciała a stanem zdrowia zarówno w populacji ogólnej, jak i wśród chorych na mukowiscydozę – w tej grupie osób stan odżywienia odgrywa kluczową rolę. Udowodniono, że obniżona zawartość beztłuszczowej masy ciała (FFM) u pacjentów z CF wykazuje negatywny wpływ na przebieg choroby podstawowej, powoduje osłabienie siły mięśni oddechowych, pogorszenie funkcji płuc, zwiększenie ryzyka zaostrzenia choroby oskrzelowo-płucnej oraz nasilenie stanu zapalnego (2, 8), a także wydłuża czas i (lub) częstotliwość hospitalizacji. Z drugiej strony większy udział FFM w składzie ciała powiązano z poprawą funkcji płuc, a także lepszą gęstością mineralną kości. Nadmiar tkanki tłuszczowej może z kolei niekorzystnie oddziaływać na stężenie glukozy na czczo, wrażliwość tkanek na insulinę oraz wywoływać insulinooporność (18).
W porównaniu z osobami zdrowymi chorzy na mukowiscydozę charakteryzują się niższą zawartością beztłuszczowej masy ciała oraz niższą gęstością mineralną kości (2). Dodatkowo coraz częściej obserwuje się w tej grupie nadwagę, otyłość i otyłość przy normalnej masie ciała (8). Zjawiska te występują najprawdopodobniej wskutek nieprawidłowych nawyków żywieniowych oraz niedostatecznej aktywności fizycznej. Często zdarza się jeszcze, że dieta osób z mukowiscydozą charakteryzuje się wysokim spożyciem źródeł cukrów prostych (słodycze, słodkie napoje), żywności przetworzonej i nasyconych kwasów tłuszczowych przy jednocześnie niskim spożyciu błonnika pokarmowego oraz produktów wartościowych odżywczo, takich jak: ryby, rośliny strączkowe, warzywa, owoce czy orzechy (19, 20, 21). Z drugiej strony niska aktywność fizyczna dodatkowo powoduje obniżenie beztłuszczowej masy ciała, gęstości mineralnej kości oraz pogorszenie funkcji płuc. Należy jednak podkreślić fakt, że taki styl życia jest aktualnie wszechobecny i nie dotyczy jedynie osób z CF, ale całego społeczeństwa i przyczynia się do epidemii otyłości na całym świecie. Dlatego też, w grupie chorych na mukowiscydozę, należy zwracać uwagę na poprawę jakości diety, żeby zarówno zapobiegać niedożywieniu, jak i otyłości. Zgodnie z najnowszymi amerykańskimi rekomendacjami wskazane jest postępowanie żywieniowe opierające się na wyborze produktów, które mają pozytywne skutki zdrowotne w populacji ogólnej. Dieta w mukowiscydozie ma uwzględniać indywidualne preferencje pacjenta, ale zawierać w swoim składzie warzywa, owoce, produkty pełnoziarniste, owoce morza, jajka, warzywa strączkowe, orzechy, nasiona, produkty mleczne oraz mięso i drób (22). Dodatkowym wyzwaniem jest wpływ leczenia przyczynowego modulatorami CFTR na skład ciała. Obecnie długofalowe konsekwencje są niezdefiniowane (18).
Podsumowanie
Stan odżywienia oraz skład ciała są ściśle powiązane ze stanem zdrowia i czynnością płuc, dlatego indywidualna opieka dietetyczna powinna stanowić jeden z fundamentów leczenia osób chorych na mukowiscydozę. Wskaźnik masy ciała (BMI) to łatwe i najczęściej stosowane narzędzie do oceny stanu odżywienia, nie pozwala jednak na określenie składu ciała, co uniemożliwia prognozowanie zdrowotnych następstw niedoboru lub nadmiaru poszczególnych komponentów. Analiza składu ciała może zatem pogłębić ocenę stanu odżywienia, m.in. wykrywać nadmiar tkanki tłuszczowej przy normalnej masie ciała, jak również pozwala na określenie ewentualnych deficytów w beztłuszczowej masie ciała. Dodatkowo, nowym wyzwaniem jest ustalenie indywidualnych zaleceń dietetycznych wśród pacjentów stosujących leczenie przyczynowe, żeby nie doprowadzać do powstawania nadmiernej tkanki tłuszczowej, a utrzymywać masę mięśniową na odpowiednim poziomie. Regularne monitorowanie zmian składu ciała może stać się więc ważnym elementem w dogłębnej ocenie stanu odżywienia oraz być pomocne w podejmowaniu decyzji w procesie indywidualizacji zaleceń żywieniowych.
Bibliografia
- King S.J., Nyulasi I.B, Boyd J.G. i in. Fat-free mass depletion in cystic fibrosis: Associated with lung disease severity but poorly detected by body mass index. Nutrition. Jul-Aug 2010; 26 (7-8): 753–759.
- Calella P., Valerio G., Brodlie M. i in. Cystic fibrosis, body composition, and health outcomes: a systematic review. Nutrition. 2018 Nov; 55–56: 131–139.
- Turck D., Braegger C.P., Colombo C. i in. ESPEN-ESPGHAN-ECFS guidelines on nutrition care for infants, children, and adults with cystic fibrosis. Clin Nutr. 2016 Jun; 35(3): 557–577.
- Leskinen L., Eloranta A.M., Tompuri T. i in. Changes in body composition by age and obesity status in preschool-aged children: the STEPS study. Eur J Clin Nutr. 2021 Jan; 75(1): 57–65.
- Wąsowski M., Walicka M., Marcinowska-Suchowierska E. Otyłość – definicja, epidemiologia, patogeneza. Postępy Nauk Medycznych, t. XXVI, nr 4, 2013.
- Olszanecka-Glinianowicz M., Stoś K., Gajda-Wyrębek J. Stanowisko Polskiego Towarzystwa Badań nad Otyłością, Narodowego Instytutu Zdrowia Publicznego – Państwowego Zakładu Higieny, Instytutu Żywności i Żywienia im. prof. dra med. Aleksandra Szczygła w sprawie stosowania niskokalorycznych substancji słodzących. Nutrition, Obesity & Metabolic Surgery 2019; 6, 1: 1–6.
- Przygoda B., Wierzejska R., Matczuk E. i in. Witaminy [w:] Jarosz M. (red.): Normy żywienia dla populacji Polski i ich zastosowanie, Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, Warszawa 2020, 207.
- Alvarez J.A., Ziegler T.R , Millson E.C. i in. Body composition and lung function in cystic fibrosis and their association with adiposity and normal-weight obesity. Nutrition. 2016 Apr; 32(4): 447–452.
- Harindhanavudhi T., Wang Q., Dunitz J. i in. Prevalence and factors associated with overweight and obesity in adults with cystic fibrosis: A single-center analysis. J Cyst Fibros. 2020 Jan; 19(1): 139–145.
- Orsso C.E., Tibaes J.R., Oliveira C.L. i in. Low muscle mass and strength in pediatrics patients: Why should we care? Clin Nutr. 2019 Oct; 38(5): 2002–2015.
- Dżygadło B., Łepecka-Klusek C., Pilewski B. Wykorzystanie analizy impedancji bioelektrycznej w profilaktyce i leczeniu nadwagi i otyłości. Probl Hig Epidemiol 2012, 93(2): 274–280.
- Różdżyńska-Świątkowska A., Kułaga Z., Grajda A. i in. Wartości referencyjne wysokości, masy ciała i wskaźnika masy ciała dla oceny wzrastania i stanu odżywienia dzieci i młodzieży w wieku 3–18 lat. Standardy medyczne/Pediatria, 2013 t. 1, 1121.
- Saxby N. i in. Nutrition Guidelines for Cystic Fibrosis in Australia and New Zealand. Bell S, editor. Sydney: Thoracic Society of Australia and New Zealand; 2017.
- Mielus M., Walicka-Serzysko K., Sands D. Rozpoznawanie i leczenie mukowiscydozy. Podsumowanie wytycznych European Cystic Fibrosis Society 2018. Medycyna Praktyczna, 2019, nr 6.
- Mańko M. Wykorzystanie właściwości elektrycznych tkanek w pomiarach biomedycznych metodą impedancji bioelektrycznej. Prace doktorantów Politechniki Lubelskiej – 2020, Lublin, 2020.
- Lewitt A., Mądro E., Krupienicz A. Podstawy teoretyczne i zastosowania analizy impedancji bioelektrycznej (BIA). Endokrynol. Otył. Zab. Przem. Mat 2007; 2(4): 79–84.
- Szajewska H., Horvath A. Żywienie i leczenie żywieniowe dzieci i młodzieży. Medycyna Praktyczna, Kraków, 2017.
- Soltman S., Hicks R.A, Khan F.N. i in. Body composition in individuals with cystic fibrosis. J Clin Transl Endocrinol. 2021 Dec; 26: 100272.
- Sutherland R. i in. Dietary intake of energy‐dense, nutrient‐poor and nutrient‐dense food sources in children withcystic fibrosis. J Cys Fibros. 2018.
- Calvo‐Lerma J. i in. The relative contribution of food groups to macronutrient intake in children with cystic fibrosis: a European multicenter assessment. J Acad Nutr Diet. 2019.
- Poulimeneas, D. i in. Adherence to Dietary Recommendations, Nutrient Intake Adequacy and Diet Quality among Pediatric Cystic Fibrosis Patients: Results from the GreeCF Study. Nutrients. 2020.
- McDonald C.M., Alvarez J.A., Bailey J. i in. Academy of Nutrition and Dietetics: 2020 Cystic Fibrosis Evidence Analysis Center Evidence-Based Nutrition Practice Guideline. Journal of the Academy of Nutrition and Dietetics. 2021; 121(8): 1591–1636.