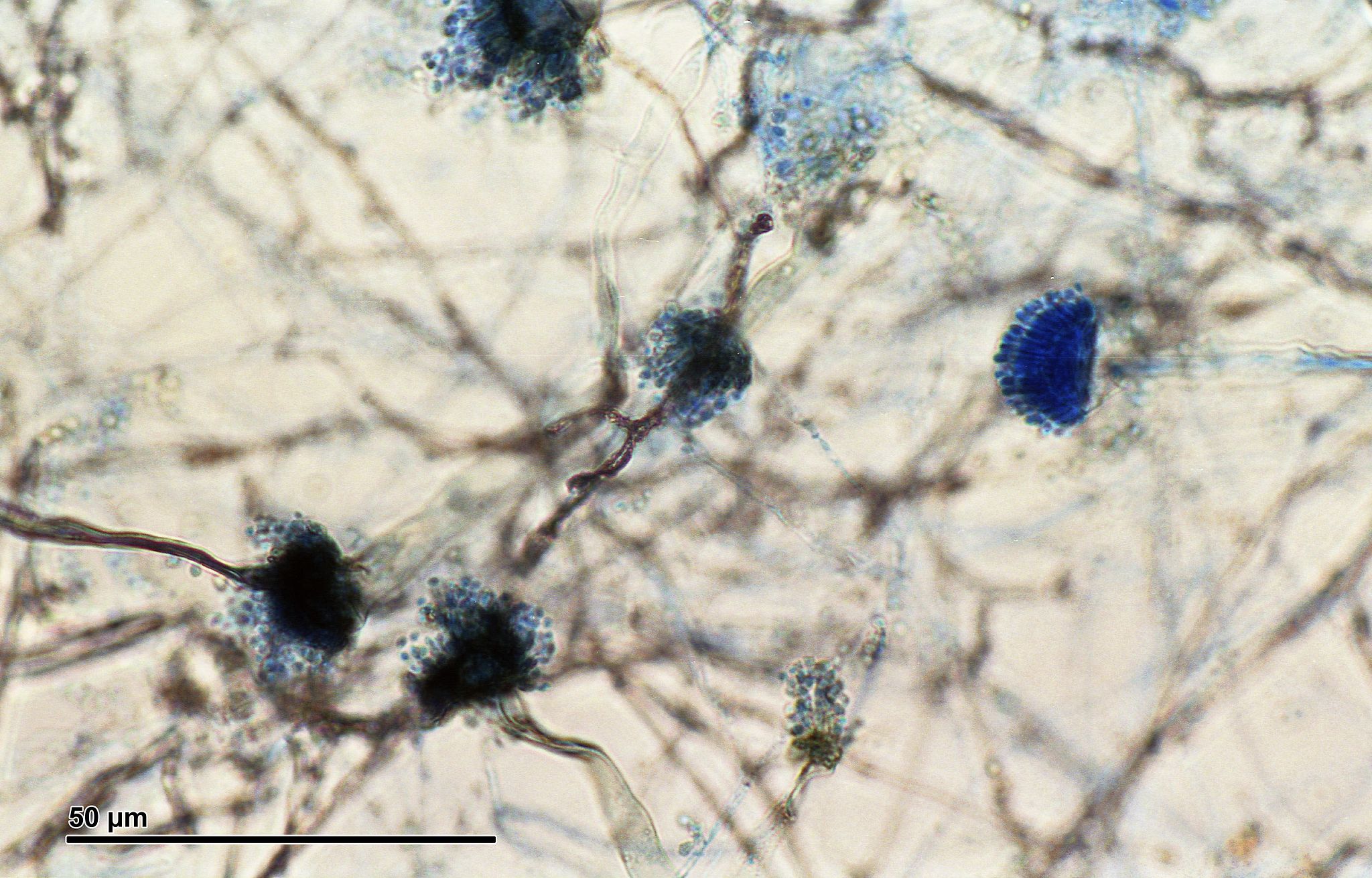
Aspergiloza jako choroba wywoływana przez grzyba z rodzaju Aspergillus spp. może przybierać różne formy. Począwszy od ABPA, czyli alergicznej aspergilozy oskrzelowo-płucnej, poprzez przewlekłą aspergilozę płucną (CPA) po gwałtownie przebiegającą inwazyjną aspergilozę (IA) płucną lub rozsianą. Według danych z 2017 r. szacowana liczba osób chorujących na postać przewlekłą aspergilozy na świecie to ok. 3 milionów. Postać inwazyjna to około 250 tysięcy przypadków na rok. W ostatnich 20 latach obserwuje się wzrost zachorowalności na postać przewlekłą, jak i inwazyjną. Wynika to ze wzrastającej liczby przeszczepów narządów, przeszczepów komórek macierzystych oraz osób leczonych immunosupresyjnie z innych powodów 1.
Inwazyjna postać aspergilozy
Do postaci inwazyjnej dochodzi w sytuacji, gdy strzępki grzyba wnikają do miąższu płucnego, naciekają naczynia krwionośnie, powodując tym samym powstanie miejscowych zatorów, zakrzepów i ognisk zawałowych. Następnie drogą krwionośną (po nacieczeniu naczyń płucnych) fragmenty grzybni mogą zostać przeniesione do odległych narządów (inwazyjna postać rozsiana). Głównym czynnikiem ryzyka, a więc sprzyjającym wystąpieniu zakażenia inwazyjnego, jest brak wystarczającej obrony gospodarza, czyli zaburzenia odporności. Dotyczy to przede wszystkim neutrofilów – obniżenia ich liczby (neutropenia). Aczkolwiek IA może wystąpić również u pacjentów bez współistniejącej neutropenii 2.
Inne czynniki ryzyka IA zawarto w tabeli 1.
| Czynniki ryzyka rozwoju inwazyjnej aspergilozy |
|---|
| Stosowanie glikokortykosteroidów systemowych (leczenie immunosupresyjne) |
| Choroby nowotworowe krwi |
| Przedłużająca się neutropenia |
| Hemodializy |
| Choroby wątroby |
| Przewlekłe choroby płuc: mukowiscydoza, przewlekła obturacyjna choroba płuc itp. |
| Przewlekłe choroby ziarniniakowe |
| Przeszczep narządu, komórek krwiotwórczych |
| Krytyczny stan pacjenta wymagający hospitalizacji w oddziale intensywnej terapii |
Objawy inwazyjnej aspergilozy zależą od lokalizacji pierwotnej zakażenia. Najczęściej są to płuca. Jednym z pierwszych symptomów jest gorączka. U pacjentów z neutropenią występuje u ok. 95%. Następnie dołącza ból w klatce piersiowej. Kaszel początkowo suchy, stopniowo nasilający się i przechodzący w kaszel produktywny. Obserwuje się krwioplucie od łagodnego do masywnego. Efektem narastającej niewydolności oddechowej jest duszność. Stan kliniczny pacjenta ulega dynamicznemu pogarszaniu się 3.
W trakcie rozsiewu strzępek grzyba zajmowane są kolejne układy i narządy, co skutkuje dołączeniem dodatkowych objawów, np. zaburzeniami neurologicznymi (w przypadku zajęcia ośrodkowego układu nerwowego), głębokimi ubytkami skórnymi pokrytymi czarnym strupem, niewydolnością wątroby.
W przypadku osób z IA bez współistniejącej neutropenii wymienione powyżej objawy występują rzadziej, często o mniejszym nasileniu, np. gorączkę stwierdza się tylko u 50–70% chorych. Podobnie jest w kwestii kaszlu, bólu w klatce piersiowej czy krwioplucia.
Jednakże zarówno gorączka, kaszel, ból w klatce piersiowej czy krwioplucie występują w wielu schorzeniach układu oddechowego i na ich podstawie nie można ustalić rozpoznania. W tym celu konieczne jest wykonanie badań obrazowych, laboratoryjnych i mykologicznych 4.
W badaniach radiologicznych obraz IA może być różnorodny. Początkowo pojawiają się drobne zmiany guzkowe, najczęściej obustronnie. Mogą być one niewidoczne w klasycznym badaniu rentgenowskim, stąd często konieczność wykonania badania tomograficznego płuc o dużej rozdzielczości (HRCT). Charakterystycznym, choć nie patognomonicznym – czyli typowym tylko dla danej choroby – zjawiskiem jest „objaw halo”, gdy w otoczeniu guzków pojawiają się obłoczkowate zagęszczenia, tzw. obszary mlecznej szyby. W przypadku pacjentów z IA bez neutropenii ten objaw występuje rzadziej. Częściej natomiast uwidocznione zostają zagęszczenie pęcherzykowe, pasmowate nacieki zalane. Zajęciu może ulec opłucna.
W miarę postępu choroby obserwuje się progresję zmian radiologicznych. Zwiększa się ich ilość, jak i rozległość zajętego miąższu płucnego. W miejscach uprzednio stwierdzanego „objawu halo” z czasem wytworzyć może się jama, a następnie dołączyć objaw półksiężyca – co świadczy miejscowym krwawieniu. W zależności od obrazu radiologicznego postać płucną IA podzielono na postać o charakterze zapalenia płuc i opłucnej, guzków z towarzyszącą martwicą i wtórnym tworzeniem się jam, ropnia płuc lub w przypadku najcięższym – zawału krwotocznego płuca.
Przy czym istotne jest, że nie można postawić rozpoznania IA tylko na podstawie objawów i badania obrazowego. Aktualnie, niestety, medycyna nie dysponuje pojedynczym testem, który mógłby pretendować do miana „złotego standardu”. Do pełnej diagnozy wymagane są badania laboratoryjne, w tym mykologiczne. Najbardziej wiarygodne to stwierdzenie w popłuczynach oskrzelowo-pęcherzykowych (BAL) obecności strzępek grzybni kropidlaka lub wykazanie ich obecności w preparacie bezpośrednim materiału z zakażonych tkanek. Pomocniczo zastosowanie znajdują metody immunodetekcji galaktomannanu (składnika ściany komórkowej kropidlaka) w surowicy krwi oraz stosunek stężenia galaktomannanu w BAL do stężenia galaktomannanu w surowicy. U pacjentów z neutropenią, zwłaszcza w początkowym etapie choroby, sugeruje się dwukrotne wykonanie badań. W tej grupie pacjentów czułość powyższych metod jest stosunkowo wysoka i wynosi 60–70%. W przypadku pacjentów bez neutropenii czułość badania oscyluje w granicach 15–20%, a u osób z chorobą ziarniniakową 0% i nie znajduje zastosowania. Wyniki fałszywie dodatnie mogą być skutkiem leczenia antybiotykami syntetyzowanymi w oparciu o grzyby (m.in. penicyliny i ich pochodne), spożywaniem pokarmów zawierających galaktomannan (makaron, ryż), kolonizacją Bifidobacterium (pałeczkowate bakterie gram-dodatnie wchodzące w skład probiotyków).
Innymi badaniami dodatkowy-mi przybliżającymi rozpoznanie IA są: ocena DNA kropidlaka w surowicy i BAL-u (przy użyciu metody PCR), detekcja specyficznych dla Asperillus białek ściany komórkowej (LFD) w BAL-u, stwierdzenie obecności 1,3-β-D-glukanu poprzez aktywację czynnika G w surowicy.
Na najbardziej obiecującą kombinację badań dodatkowych składają się: DNA PCR i (lub) LFD i (lub) ocena galaktomannanu w BAL-u oraz surowicy i (lub) wysokie stężenie interleukiny 8 w surowicy. Niestety, w chwili obecnej nie wszystkie powyższe badania dostępne są w Polsce 5.
Leczenie IA
Włączenie wczesnego leczenia systemowego przeciwgrzybiczego stanowi istotny czynnik rokowniczy i decyduje o przeżywalności chorych. Aktualnie śmiertelność w przypadku IA sięga 30–40%. Wciąż prowadzone są badania nad nowymi lekami przeciwgrzybiczymi zwiększającymi skuteczność leczenia. Obecnie główne zastosowanie w farmakoterapii znajdują 6:
- Voriconazol – rekomendowany w terapii pierwszego rzutu, stosowany przez minimum 12 tygodni, początkowo w formie dożylnej, a następnie w leczeniu podtrzymującym doustnie. Lek ten zaliczany jest do grupy azoli – związków odpowiadających za obumarcie komórki grzyba poprzez hamowanie syntezy ergosteroli w błonie komórkowej.
- Isavuconazol – azol, również rekomendowany jako lek pierwszego rzutu.
- Amfoterycyna B – aktualnie wykorzystywana w leczeniu IA noworodków. Poza powyższą grupą, wykazuje istotnie słabsze działanie terapeutyczne w porównaniu z azolami.
- Kapsofungina – lek zaliczany do grupy echinokandyn, mechanizm swojego działania opiera na inhibicji syntezy 1,3-β-D-glukanu. Stosowana jest w przypadku niezadowalającej odpowiedzi na monoterapię voriconazolem, nawrotowych IA oraz u pacjentów ze schorzeniami hematoonkologicznymi i po przeszczepie narządów (w schematach leczenia łączonego).
- Posaconazol – leki z grupy azoli, stosowane podobnie jak kapsofungina w przypadku nawrotowych IA, braku odpowiedzi na voriconazol czy w schematach leczenia łączonego.
- Przewlekła płucna aspergiloza
Mianem przewlekłej płucnej aspergilozy (przewlekłej martwiczej aspergilozy płucnej, semiinwazyjnej płucnej aspergilozy) określa się przewlekłą, powolnie postępującą chorobę miąższu płuc wywoływaną kropidlakiem. Różnica pomiędzy postacią przewlekłą aspergilozy w porównaniu z postacią inwazyjną polega na tym, że strzępki grzybni, naciekając miąższ płucny, nie penetrują do światła naczyń. Stąd też dynamika procesu chorobowego, jak i nasilenie objawów są mniejsze. Nie zmienia to jednak faktu, że przewlekłość procesu w efekcie końcowym i tak może skutkować całkowitą destrukcją miąższu płuc. Przewlekła aspergiloza płucna najczęściej dotyka osoby z mniej istotnymi niż w przypadku IA zaburzeniami odporności, a także osoby z już istniejącymi schorzeniami układu oddechowego. Z reguły są to osoby dorosłe. Występowanie postaci przewlekłej u dzieci zdarza się bardzo rzadko.
Objawy przewlekłej płucnej aspergilozy nie są charakterystyczne. Początkowo niezauważalne, stopniowo przybierają na sile. Mogą występować stany podgorączkowe, kaszel produktywny z odkrztuszaniem wydzieliny ropnej i (lub) rdzawo podbarwionej, stopniowy spadek masy ciała, krwioplucie. W miarę postępu choroby dołączają objawy związane z ubytkiem czynnego miąższu płucnego, jak pogorszenie tolerancji wysiłku fizycznego, duszność.
W zależności od obrazu radiologicznego, pokrywającego się z obrazem histopatologicznym, dokonano podziału przewlekłej aspergilozy płucnej na postać: przewlekłą jamistą, przewlekłą guzkową, przewlekłą włóknistą. W postaci przewlekłej jamistej dominują jamy powstające na skutek procesów martwiczo-zapalnych, w niezmienionym uprzednio miąższu płucnym. W postaci guzkowej dominują guzki. W postaci włóknistej dochodzi do włóknienia miąższu płuc, mogą wtórnie pojawiać się jamki, jamy 7.
Rozpoznanie ustala się na podstawie objawów klinicznych (wymagany jest co najmniej trzymiesięczny okres utrzymywania się dolegliwości), badań obrazowych oraz badań laboratoryjnych. Z diagnostyki mykologicznej zastosowanie znajdują testy serologiczne określające stężenie we krwi przeciwciał w klasie G (IgG) dla antygenów kropidlaka. W plwocinie, popłuczynach oskrzelowo-pęcherzykowych można obserwować pojedyncze strzępki grzybni. W przypadku pobrania chirurgicznego (biopsji) z miejsca zmienionego chorobowo prawdopodobieństwo uzyskania w materiale strzępek grzyba jest istotnie większe. Inne biomarkery, jak i testy stosowane w diagnostyce IA, w tym przypadku z reguły dają ujemne wyniki 6.
Z racji powolnego przebiegu przewlekła aspergiloza płucna rozpoznawana jest stosunkowo późno. W leczeniu stosuje się przede wszystkim azole. Obecnie rekomendowane jest leczenie itrakonazolem (minimalnie 6 tygodni, jeśli uzyska się poprawę kliniczną i ustępowanie zmian radiologicznych, optymalnie 6 miesięcy). Ewentualnie jako lek pierwszego rzutu zastosowanie znajduje voriconazol. Posaconazol jest leczeniem alternatywnym. Sporadycznie farmakoterapię uzupełnia leczenie chirurgiczne – resekcja zmienionej tkanki płucnej. Decyzję o takim sposobie leczenia podejmuje się indywidualnie 9.
Nieco odmienną postacią przewlekłej aspergilozy płucnej jest grzybniak kropidlakowy. W tym przypadku Aspergillus wnika do „jamy” już istniejącej w miąższu płucnym. Mogą to być jamy pogruźlicze, pęcherze rozedmowe, rozstrzenie oskrzeli, zmiany marskie płuca. Na skutek rozwoju grzybni, indukującej procesy zapalne, w środku jamy pojawiają się elementy komórkowe, jak rozpadłe krwinki, dodatkowo włóknik, śluz i masy bezpostaciowe. W obrazie radiologicznym klatki piersiowej uwidoczniony zostaje charakterystyczny cień okrągły z rąbkiem powietrza pomiędzy grzybniakiem a ścianą jamy. Grzybniak przez długi okres czasu (lata) może nie powiększać swych rozmiarów. W innych przypadkach wzrost jamy grzybniaka jest stały. Sama choroba, podobnie jak w przypadku innych postaci przewlekłej aspergilozy, początkowo może nie dawać objawów. Następnie pojawiają się dolegliwości o charakterze kaszlu, z odkrztuszaniem ropnej wydzieliny, krwioplucie, osłabienie, ubytek masy ciała. Zdarzają się masywne krwotoki płucne.
Nie istnieje idealne leczenie farmakologiczne tej postaci przewlekłej aspergilozy. Najskuteczniejszym jak dotychczas postępowaniem jest resekcja chirurgiczna grzybniaka wraz z otaczającą tkanką płucną, czasem wsparta leczeniem przeciwgrzybiczym. W 5–10% przypadków grzybniak
obumiera samoistnie 10.
Choroby wywoływane przez kropidlaka nastręczają dużo trudności zarówno diagnostycznych, jak i leczniczych. Niecharakterystyczne objawy czasem mogą uśpić czujność, stąd ważne, by mieć świadomość, iż niewielkich rozmiarów grzyb, jakim jest kropidlak, może w organizmie ludzkim doprowadzić do nieodwracalnych zmian.
Bibliografia
- Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98.
- Kosmidis C., Denning D.W. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015 Mar; 70(3): 270–277.
- Kulus M., Kranke K. (red.). Pulmonologia Dziecięca. Wydawnictwo Lekarskie PZWL, Warszawa 2018; 246–247.
- Naaraayan A., Kavian R., Lederman J. et al. Invasive pulmonary aspergillosis – case report and review of literature. J Comm Hosp Inter Med Perspect. 2015; 5(1).
- Patel A.R., Singh S. et al. Diagnosing Allergic Bronchopulmonary Aspergillosis. A review. Cureus 2019, 11(4): e4550.
- Zobacz również:
Przypisy
- Patel A.R., Singh S. et al. Diagnosing Allergic Bronchopulmonary Aspergillosis. A review. Cureus 2019, 11(4): e4550.
Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98. ↩︎ - Naaraayan A., Kavian R., Lederman J. et al. Invasive pulmonary aspergillosis – case report and review of literature. J Comm Hosp Inter Med Perspect. 2015; 5(1).
Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98.
Kosmidis C., Denning D.W. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015 Mar; 70(3): 270–277. ↩︎ - Naaraayan A., Kavian R., Lederman J. et al. Invasive pulmonary aspergillosis – case report and review of literature. J Comm Hosp Inter Med Perspect. 2015; 5(1).
Kosmidis C., Denning D.W. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015 Mar; 70(3): 270–277. ↩︎ - Naaraayan A., Kavian R., Lederman J. et al. Invasive pulmonary aspergillosis – case report and review of literature. J Comm Hosp Inter Med Perspect. 2015; 5(1).
Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98.
Kosmidis C., Denning D.W. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015 Mar; 70(3): 270–277. ↩︎ - Naaraayan A., Kavian R., Lederman J. et al. Invasive pulmonary aspergillosis – case report and review of literature. J Comm Hosp Inter Med Perspect. 2015; 5(1).
Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98.
Kosmidis C., Denning D.W. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015 Mar; 70(3): 270–277.
Kulus M., Kranke K. (red.). Pulmonologia Dziecięca. Wydawnictwo Lekarskie PZWL, Warszawa 2018; 246–247. ↩︎ - Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98. ↩︎
- Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98.
Kosmidis C., Denning D.W. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015 Mar; 70(3): 270–277. ↩︎ - Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98. ↩︎
- Tamże. ↩︎
- Jenks D.J., Hoenigl M. Treatment of Aspergillosis. J Fungi 2018, 4, 98.
Kosmidis C., Denning D.W. The clinical spectrum of pulmonary aspergillosis. Thorax. 2015 Mar; 70(3): 270–277.
Kulus M., Kranke K. (red.). Pulmonologia Dziecięca. Wydawnictwo Lekarskie PZWL, Warszawa 2018; 246–247. ↩︎